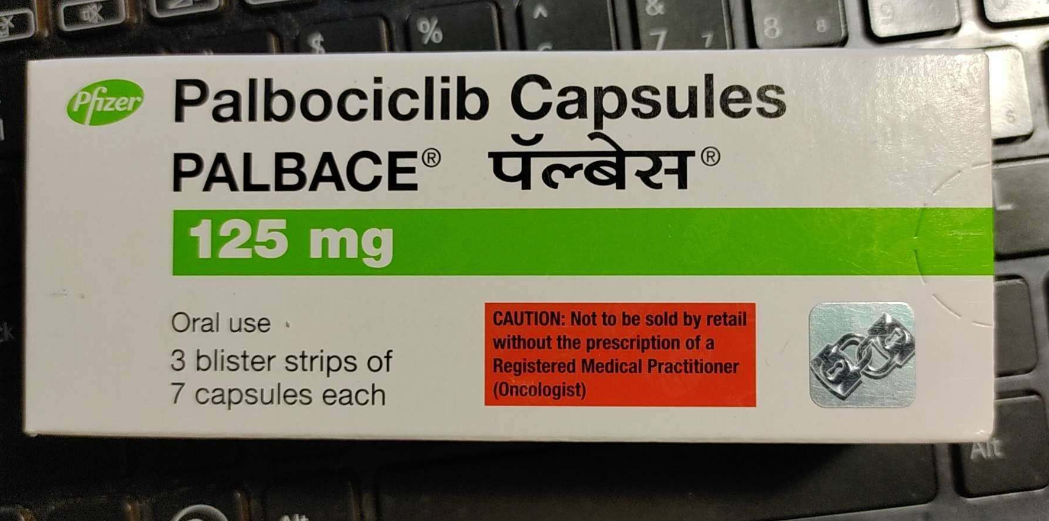
哌柏西利(帕博西尼)Palbociclib Capsules中文说明书
- 热度: ℃
- 来源:网络收集
- 收录时间:2020-09-27
【药品名称】
哌柏西利(
帕博西尼)胶囊 Palbociclib Capsules中文说明书
【适应症】本品适用于激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性
乳腺癌,应与芳香化酶抑制剂联合使用作为绝经后女性患者的初始内分泌治疗。
【规格】(1)75mg (2)100mg (3)125mg
【用法用量】应由具抗癌药物使用经验的医生开始并监督本品治疗。
哌柏西利的推荐剂量为125mg,每天1次,连续服用21天,之后停药7天(吃3周/停1周给药方案),28天为1个治疗周期。
治疗应当持续进行,除非患者不再有临床获益或出现不可接受的毒性。
当与
来曲唑联用时,
来曲唑的推荐剂量为2.5mg,口服,每天1次,在整个28天治疗周期连续服药。具体请参见来曲唑批准的说明书。
给药方法
口服。应与食物同服,最好随餐服药以确保哌柏西利暴露量一致。
哌柏西利不得与葡萄柚或葡萄柚汁同服。
哌柏西利胶囊应整粒吞服(吞服前不得咀嚼、压碎或打开胶囊)
如果胶囊出现破损、裂纹或其他不完整的情况,则不得服用。
应鼓励患者在每天大约相同的时间服药。
如果患者呕吐或者漏服,当天不得补服。应照常进行下次服药。
【剂量调整】
建议根据个体安全性和耐受性调整哌柏西利的剂量。
出现某些不良反应时可能需要暂时中断/延迟给药和/或减低剂量,或永久停药来进行控制,请参照表1、2和3中提供的方案进行剂量调整印度博生药房商城收集整理indbsa.com。
在开始哌柏西利治疗前、每个治疗周期开始时、前2个治疗周期的第15天以及有临床指征时应监测全血细胞计数。
对于前6个治疗周期内发生最高严重程度为1或2级中性粒细胞减少症的患者,其后续周期的全血细胞计数监测时间应为每3个月一次、各周期开始之前以及有临床指征时。 建议在中性粒细胞绝对计数(AbsoluteNeutrophilCount,ANC)≥1,000/mm3且血小板计数≥50,000/mm3时接受哌柏西利。
特殊人群
老年人 ≥65岁的患者无需调整哌柏西利的剂量。
儿科人群 尚未确定哌柏西利在≤18岁儿童和青少年患者中的安全性和疗效。没有数据可用。
肝损伤 轻度或中度肝损伤患者(Child-Pugh A级和B级)无需调整哌柏西利的剂量。
重度肝损伤(Child-PughC级)患者的推荐剂量为75mg,每天一次,采用3/1给药方案(见[注意事项]和[药代动力学])。
肾损伤 轻度、中度或重度肾损伤患者(肌酐清除率[CreatinineClearance,CrCl]≥15 mL/min)无需调整哌柏西利的剂量。
需要血液透析患者的数据不充分,无法对该人群提供任何剂量调整建议。
与CYP3A强效抑制剂合用时的剂量调整
避免伴随使用CYP3A强效抑制剂,考虑替换为没有或只有微弱CYP3A抑制作用的其他伴随用药。如果患者必须合用CYP3A强效抑制剂,则将哌柏西利的剂量减少至75mg,每天一次。如果停用强效抑制剂,则将哌柏西利的剂量增加至开始使用CYP3A强效抑制剂之前的剂量(在抑制剂的3至5个半衰期后)。
【不良反应】
本说明书描述了在临床试验中观察到的判断为可能由哌柏西利引起的不良反应及其近似的发生率。由于每项临床试验的条件各不相同,在一个临床试验中观察到的不良反应的发生率不能与另一个临床试验观察到的不良反应发生率直接比较,也可能不能反映临床实践中的实际发生率。
安全性特征概要
哌柏西利的总体安全性特征评估来自在HR阳性、HER2阴性晚期或转移性
乳腺癌随机研究中接受哌柏西利与内分泌疗法联合治疗(527例与来曲唑联用和345例与
氟维司群联用)的872例患者的合并数据[包括研究PALOMA-1(A5481003),研究PALOMA-2(A5481008),研究PALOMA-3(A5481023)]。
临床研究中,接受哌柏西利治疗的患者报告的最常见(≥20%)的任何级别的不良反应为中性粒细胞减少症、感染、白细胞减少症、疲乏、恶心、口腔炎、贫血、脱发和腹泻。
哌柏西利的最常见(≥2%)的≥3级不良反应为中性粒细胞减少症、白细胞减少症、贫血、疲乏和感染。
在研究PALOMA-2中评估了哌柏西利(125mg/天)联合来曲唑(2.5mg/天)治疗对照安慰剂联合来曲唑治疗的安全性。哌柏西利联合来曲唑的中位治疗持续时间为19.8个月,而安慰剂联合来曲唑的中位治疗持续时间为13.8个月。在接受哌柏西利联合来曲唑治疗的患者中,有36%的患者因任何级别的不良反应而减量。43/444(9.7%)例接受哌柏西利联合来曲唑治疗的患者以及13/222(5.9%)例接受安慰剂联合来曲唑治疗的患者发生了与不良反应相关的永久停药。导致接受哌柏西利联合曲唑治疗的患者永久停药的不良反应包括中性粒细胞减少症(1.1%)和丙氨酸转氨酶升高(0.7%)。
不良反应列表
表4报告了3项随机研究[研究PALOMA-1(A5481003),研究PALOMA-2(A5481008),研究PALOMA-3(A5481023)]的合并数据集中的不良反应。合并数据集中哌柏西利治疗的中位持续时间为12.7个月。
表5报告了3项随机研究的合并数据集中的实验室检查异常。 按系统器官分类和发生频率列出不良反应。发生频率定义为:十分常见(≥1/10)、常见(≥1/100至<1/10)和偶见(≥1/1,000至<1/100)。
在PALOMA-2和PALOMA-3两项研究中,纳入了200例亚裔患者。在接受哌柏西利的亚裔患者中报告的3级或4级中性粒细胞减少症和白细胞减少症发生率高于非亚裔患者,因而在亚裔患者中的剂量中断、剂量减少和周期延迟发生频率也略高于非亚裔患者,但通过方案规定的剂量调整可控制总体安全性,亚裔患者与非亚裔患者具有相似的中位治疗持续时间。根据对已有的哌柏西利剂量暴露、安全性和疗效数据进行的累积分析,将125mg每日一次作为亚裔患者的起始剂量是恰当的。
需根据患者个体的安全性和耐受性,严格遵循说明书调整哌柏西利剂量。
特定不良反应的描述
总体而言,3项随机研究中有703例(80.6%)无论以何种联用方案接受哌柏西利治疗的患者报告了任何级别的中性粒细胞减少症,其中分别有482例(55.3%)和88例(10.1%)患者报告3级和4级中性粒细胞减少症(见表4)。 3项随机临床研究中,至首次发生任何级别中性粒细胞减少症的中位时间为15天(12-700天),≥3级中性粒细胞减少症的中位持续时间为7天。 0.9%接受哌柏西利与
氟维司群联用和2.1%接受哌柏西利与来曲唑联用的患者报告了发热性中性粒细胞减少症。 在总体临床研究中,大约2%接受哌柏西利治疗的患者曾报告过发热性中性粒细胞减少症。
【禁忌】对活性成分或章节[成分]项下所列的任一辅料过敏者禁用。
禁止使用含圣约翰草(贯叶金丝桃/中药名)的制品。
【注意事项】
【绝经前/围绝经期女性】
鉴于芳香化酶抑制剂的作用机制,绝经前/围绝经期女性接受哌柏西利与芳香化酶抑制剂联合治疗时,必须进行卵巢切除或使用促黄体生成激素释放激素(LuteinizingHormoneReleasingHormone,LHRH)激动剂抑制卵巢功能。
哌柏西利联合氟维司群用于绝经前/围绝经期女性的研究中,仅与LHRH激动剂联合用药。
【危重内脏疾病(转移)】
尚未在危重的有内脏疾病(转移)患者中研究哌柏西利的疗效和安全性。
【血液学毒性】
中性粒细胞减少症是临床研究中最常报告的不良反应,临床研究中大约有2%的接受哌柏西利治疗的患者曾报告过发热性中性粒细胞减少症,并报告了1例中性粒细胞减少性败血症引起的死亡。
应在哌柏西利治疗开始前、每个周期开始时、前两个周期的第15天以及出现临床指征时监测全血细胞计数。对于出现3或4级中性粒细胞减少症的患者,建议中断给药、减少剂量或延迟开始治疗周期,并进行密切监测。医生应告知患者立即报告任何发热事件。
【感染】因为哌柏西利具有骨髓抑制特性,其可使患者易于出现感染。 多项随机研究报道了哌柏西利组患者的感染率高于各自的对照组患者。分别有4.5%和0.7%的接受哌柏西利任何联用方案治疗的患者发生了3级和4级感染。 应监测患者的感染体征和症状并且适当时应给予治疗。 患者在出现任何骨髓抑制或感染体征或症状时立即报告,例如发热、寒战、头晕、气短、无力或出血和/或瘀伤倾向加重。
【肝损伤】中度或重度肝损伤患者应慎用哌柏西利,并密切监测毒性体征。
【肾损伤】中度或重度肾损伤患者应慎用哌柏西利,并密切监测毒性体征。
【与CYP3A4抑制剂或诱导剂联合治疗】
强效CYP3A4抑制剂可导致毒性增加。哌柏西利治疗期间应避免与强效CYP3A抑制剂合用。仅在认真评估潜在获益和风险后才可考虑同时使用。如不能避免与强效CYP3A抑制剂同时使用,应将哌柏西利的剂量降至75 mg每天一次。停止使用强效抑制剂时,应将哌柏西利的剂量(抑制剂的3-5个半衰期后)增加至开始使用强效CYP3A抑制剂前的剂量。 与CYP3A诱导剂同时使用可导致哌柏西利的暴露量降低,所以有缺乏疗效的风险。因此,应避免哌柏西利与强效CYP3A4诱导剂合用。哌柏西利与中效CYP3A诱导剂同时使用时无需调整剂量。
【有生育能力的女性或其配偶】有生育能力的女性或其男性配偶在使用哌柏西利治疗期间必须使用一种高效的避孕方法。
【乳糖】哌柏西利含乳糖。存在半乳糖不耐症、Lapp乳糖酶缺乏症或葡萄糖-半乳糖吸收不良症等罕见遗传疾病的患者不得服用哌柏西利。 对驾驶和操作机器能力的影响 哌柏西利对驾驶和操作机器能力的影响很小。但是,哌柏西利可能引起疲乏,患者在驾驶或操作机器时应谨慎。
【孕妇及哺乳期妇女用药】有生育能力的女性/避孕 接受本药品治疗的有生育能力的女性或其男性配偶,应在治疗期间以及完成治疗后分别至少3周(女性)或14周(男性)内采取充分的避孕措施(如,双重屏障避孕)。
【妊娠】尚缺乏关于孕妇使用哌柏西利的数据或数据有限。动物研究显示哌柏西利具有生殖毒性。不建议孕妇和未采取避孕措施的有生育能力的女性使用哌柏西利。
【哺乳】尚未在人体或动物中进行相关研究以评价哌柏西利对乳汁生成的影响、是否存在于母乳中或对母乳喂养婴儿的影响。尚不清楚哌柏西利是否会分泌至人类乳汁中。接受哌柏西利治疗的患者不应哺乳。
【生育力】在非临床生殖毒性研究中,未发现对大鼠的发情周期(雌性)或交配和生育力(雄性和雌性)有影响。尚未获得对人类生育力影响的临床数据。根据非临床安全性研究中雄性生殖器官的变化(睾丸曲细精管变性、附睾精子减少、精子活力和密度降低以及前列腺分泌减少),哌柏西利治疗可能会损害男性的生育力。因此,男性在开始哌柏西利治疗前应考虑保存精液。
【儿童用药】尚未确定哌柏西利在18岁及以下的儿童和青少年患者中的安全性和疗效。尚无相关数据。
【老年用药】在PALOMA-2研究中接受哌柏西利治疗的444例患者中,181(41%)例患者≥65岁,48(11%)例患者≥75岁。未发现上述患者与年轻患者在哌柏西利的安全性或有效性方面存在差异。65岁及以上患者无需调整哌柏西利的剂量。
2023-08-21
palbociclib帕博西尼是一种周期蛋白-依赖激酶(CDK)4和6的抑制,通过阻断细胞从细胞周期G1进入S期,以减低雌激素受体(ER)-阳性乳癌细胞株的增殖。
...
2023-08-21
帕博西尼是一种口服的、靶向的CDK4/6抑制剂,其作用是在一定程度上抑制疾病的发展,控制肿瘤细胞的增殖,用于治疗激素受体阳性、人表皮生长因子受体2阴性的局部晚期或...
2023-08-21
帕博西尼是一种实验性、口服、靶向性制剂,能够选择性抑制细胞周期蛋白依赖性激酶4和6(CDK4/6),恢复细胞周期控制,阻断肿瘤细胞增殖。
...

2023-08-21
帕博西尼是靶向药,作为首个高特异性、可逆性的CDK4/6抑制剂,在目前临床上主要用于治疗激素受体阳性、人表皮生长因子受体2阴性的局部晚期或转移性乳腺癌。
...
2023-08-21
帕博西尼/哌柏西利是细胞周期蛋白依赖性激酶4和6的抑制剂,能够减少雌激素受体阳性乳腺癌细胞系的细胞增殖,主要用于治疗激素受体阳性、人表皮生长因子受体2阴性的局...