治疗晚期前列腺癌新药Orgovyx(relugolix)FDA获批
- 热度: ℃
- 来源:网络收集
- 收录时间:2020-12-22
导读:Orgovyx(relugolix)是一种口服促性腺激素释放激素(GnRH)受体拮抗剂,可用于治疗晚期前列腺癌的成年患者。
公司: Myovant Sciences
批准日期: 2020年12月18日
治疗:前列腺癌
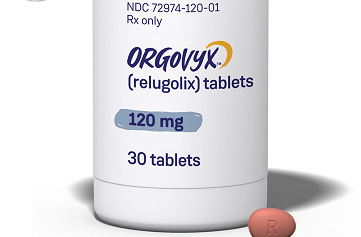
Orgovyx(relugolix)是一种口服促性腺激素释放激素(GnRH)受体拮抗剂,可用于治疗晚期前列腺癌的成年患者。
FDA批准Orgovyx(relugolix)作为晚期前列腺癌的首个口服促性腺激素释放激素(GnRH)受体拮抗剂
2020年12月18日,瑞士巴斯尔(GLOBE NEWSWIRE)-专注于重新定义男女保健的医疗公司Myovant Sciences(NYSE:MYOV)今天宣布,美国食品药品监督管理局(FDA)已批准Orgovyx(relugolix)用于治疗晚期前列腺癌的成年患者。被FDA授予优先审查权的Orgovyx是晚期前列腺癌男性的首个也是唯一的口服促性腺激素释放激素(GnRH)受体拮抗剂。该批准基于Orgovyx对晚期前列腺癌男性进行的3期HERO研究的功效和安全性数据。Orgovyx预计将于2021年1月上市。
卡罗莱纳州泌尿外科研究中心医学主任Neal Shore医师表示:“我对Orgovyx的批准感到非常高兴,并相信它有可能为需要雄激素剥夺疗法的前列腺癌患者引入新的护理标准。 HERO计划指导委员会成员。“目前,我们首次每天一次口服治疗,能够有效,迅速地抑制睾丸激素,安全性分析显示,与目前的标准照护剂-亮丙瑞林注射液相比,主要不良心血管事件的发生率更低。第三阶段HERO研究。COVID-19大流行病提高了口服治疗的重要性,因为患有前列腺癌的男性继续遇到困难并冒着接受注射的风险。
前列腺癌是一个非常个人的旅程,但是一个普遍的真理是,我们患有这种疾病的人需要更好的治疗方法和选择。这就是为什么批准Orgovyx如此激动人心的里程碑,为晚期前列腺癌男性带来了期待已久的口服治疗选择的原因,”前列腺健康教育网络总裁兼创始人Thomas Farrington说。“对于男性来说,与他们的医生交谈并探究适合他们的治疗非常重要,因为他们专注于整体健康。”
Myovant首席执行官Lynn Seely医师表示:“经过Orgovyx的批准,患有晚期前列腺癌的男性现在有了一种新的口服治疗方案,该方案已显示出强大的疗效和安全性,所有这些方案每天服用一粒。 Sciences,Inc.。“我们已经成功建立了商业能力,将这种新批准的治疗方法带给照顾晚期前列腺癌男性的泌尿科医师和
肿瘤学家,目的是将Orgovyx确立为新的护理标准。我们非常感谢参与HERO研究的人员和研究人员以及FDA通过Orgovyx的优先审阅途径加快了审阅和批准。”
在3期HERO研究中,相比之下,Orgovyx达到了主要终点,并且在48周内达到了96.7%(95%的置信区间[CI]:94.9-97.9)男性的睾丸激素持续抑制至去势水平(<50 ng / dL)。接受醋酸亮丙瑞林注射的男性中有88.8%(95%CI:84.6-91.8),是目前的护理标准。与醋酸亮丙瑞林相比,Orgovyx还达到了几个关键的次要终点,包括在第4天和第15天将睾丸激素抑制到去势水平(分别为56%对0%和99%对12%)和对睾丸激素的显着抑制(<20 ng / dL)在第15天(78%对1%)。Orgovyx在第15天平均降低了前列腺特异性抗原(PSA),在第15天降低了83%。在一项子研究中,接受Orgovyx治疗的男性中有55%的睾丸激素水平达到了正常水平(> 280 ng / dL)或在停药后90天内恢复到基线。Orgovyx组中至少有10%的男性报告了最常见的不良事件,包括潮热,肌肉骨骼疼痛,疲劳,便秘和轻度至中度腹泻。HERO数据先前曾在2020年美国临床
肿瘤学会(ASCO)虚拟科学计划的口头报告中提出,并同时发表在《新英格兰医学杂志》上。
Myovant致力于确保在美国接受Orgovyx处方的男性在治疗过程中能够获得并获得他们可能需要的支持。作为这项承诺的一部分,Myovant正在启动Orgovyx患者支持计划,该计划提供保险验证,事先授权,为商业保险患者提供共付额支持,长达两个月的治疗免费试用以及为合格的未保险患者提供患者帮助。有关更多信息,请在星期一至星期五东部时间上午8点至晚上8点与833-ORGOVYX(833-674-6899)联系。
关于前列腺癌
前列腺癌是男性中第二大最普遍的癌症形式,并且是美国男性癌症的第二大主要死因。心血管疾病死亡率是前列腺癌男性的主要死因,占死亡人数的34%在美国患有前列腺癌的男性中,有300万以上被诊断患有前列腺癌的男性在美国还活着,据估计,到2020年,将有190,000例男性被新诊断出。
Prostate cancer is considered advanced when it has spread or come back after initial treatment and may include biochemical recurrence (rising prostate-specific antigen in the absence of metastatic disease on imaging), locally advanced disease, or metastatic disease. Front-line medical therapy for advanced prostate cancer typically involves androgen deprivation therapy, which reduces testosterone to very low levels, commonly referred to as castrate levels (< 50 ng/dL). Luteinizing hormone-releasing hormone (LHRH) receptor agonists, such as leuprolide acetate, are depot injections and the current standard of care for androgen deprivation therapy. However, LHRH receptor agonists may be associated with mechanism-of-action limitations, including the potentially detrimental initial surge in testosterone levels that can exacerbate clinical symptoms, which is known as clinical or hormonal flare, and delayed testosterone recovery after the drug is discontinued. Approximately 300,000 men are treated with androgen deprivation therapy each year.
关于Orgovyx™(relugolix)
Orgovyx(relugolix)是FDA批准的首个也是唯一的口服促性腺激素释放激素(GnRH)受体拮抗剂,可用于治疗晚期前列腺癌的成年患者。作为GnRH拮抗剂,Orgovyx可以阻断GnRH受体并减少睾丸睾丸激素的产生,睾丸睾丸激素是一种已知可刺激前列腺癌生长的激素。
适应症
Orgovyx被批准用于治疗晚期前列腺癌的成年患者。
选择重要的安全信息
雄激素剥夺疗法(例如Orgovyx)可能会延长QT / QTc间隔。提供者应考虑对于患有先天性长QT综合征,充血性心力衰竭或频繁出现电解质异常的患者以及服用已知延长QT间隔的药物的患者,雄激素剥夺治疗的益处是否超过潜在风险。电解质异常应予以纠正。考虑定期监测心电图和电解质。
女性尚未确定Orgovyx的安全性和有效性。根据动物中的发现和作用机理,Orgovyx对怀孕的女性给药可能会造成胎儿伤害和失去妊娠。建议男性和有生殖能力的女性伴侣在治疗期间以及最后一次服用Orgovyx后2周内使用有效的避孕方法。
接受Orgovyx治疗的患者中最常见的不良反应(≥10%)是潮热(54%),肌肉骨骼疼痛(30%),疲劳(26%),便秘(12%)和腹泻(12%)。
接受Orgovyx的患者中最常见的实验室异常(≥15%)为葡萄糖增加(44%),甘油三酸酯增加(35%),血红蛋白减少(28%),丙氨酸氨基转移酶增加(27%)和天冬氨酸氨基转移酶增加(18%) )。
将Orgovyx与P-gp抑制剂共同给药会增加Orgovyx的曲线下面积(AUC)和最大浓度(Cmax),这可能会增加与Orgovyx相关的不良反应的风险。避免将Orgovyx与口服P-gp抑制剂并用。如果无法避免共同给药,则应首先服用Orgovyx,至少6个小时分开给药,并更频繁地监测患者的不良反应。
将Orgovyx与P-gp和强效CYP3A诱导剂合用会降低Orgovyx的AUC和Cmax,可能会降低Orgovyx的作用。避免将Orgovyx与P-gp和强效CYP3A诱导剂合用。如果无法避免共同给药,则每天将Orgovyx剂量增加至240 mg。
关于Myovant科学
Myovant Sciences力求通过以目的为导向的科学,赋权药物和变革性倡导来重新定义对男女的护理。我们的主要候选药物瑞戈利克斯(relugolix)是每日一次的口服GnRH受体拮抗剂。Relugolix(120 mg)被FDA批准为Orgovyx™,用于成年晚期前列腺癌患者。Relugolix组合片(relugolix 40毫克,雌二醇1.0毫克和乙酸炔诺酮0.5毫克)正在接受欧洲和美国针对子宫肌瘤女性的法规审查,并且正针对子宫内膜异位症女性进行研发。我们还在开发MVT-602,一种寡肽Kisspeptin-1受体激动剂,已完成2a期女性不育的研究,作为辅助生殖的一部分。Sumitomo Dainippon Pharma Co.,Ltd.的全资子公司Sumitovant Biopharma,Ltd. 是我们的大股东。
前瞻性陈述
本新闻稿包含《 1995年私人证券诉讼改革法案》所定义的前瞻性声明。在本新闻稿中,前瞻性声明包括但不限于所有反映Myovant Sciences期望的声明和报价,包括Myovant科学界希望重新定义对妇女和男子的照料;Myovant对ORGOVYX潜在利益的期望;Myovant期望ORGOVYX将于2021年1月上市;Myovant对ORGOVYX在美国的潜在商业发布的期望,包括发布时间;Myovant的目标是将ORGOVYX建立为晚期前列腺癌的新治疗标准;Myovant计划为患者提供患者援助计划;以及此类患者协助计划的功能,
Myovant Sciences的前瞻性陈述基于管理层当前的期望和信念,并受到多种风险,不确定性,假设以及其他已知和未知因素的影响,这些因素可能导致实际结果以及某些事件的发生时间与未来结果产生重大差异前瞻性陈述所表达或暗示的内容,包括因COVID-19大流行引起或与之相关的不可预见的情况或对正常业务运营的其他干扰;Myovant对ORGOVYX成功的依赖;Myovant维持商业现场组织和分销网络的能力;ORGOVYX在医生,患者,医疗保健付款人,患者权益团体和普通医学界中的接受程度;Myovant有能力从第三方付款人那里获得ORGOVYX的优惠保障和报销;Myovant依赖第三方制造ORGOVYX。Myovant Sciences无法向您保证前瞻性陈述中反映的事件和情况将会实现或发生,并且实际结果可能与这些前瞻性陈述中表达或暗示的内容存在重大差异。可能会严重影响Myovant Sciences的运营和未来前景或可能导致实际结果与预期产生重大差异的因素包括但不限于Myovant Sciences向美国证券交易委员会提交的文件中列出的风险和不确定性( SEC),包括Myovant Sciences'中的“风险因素” 2020年11月12日提交的关于10-Q表格的季度报告,因为可能会不时修改,补充或取代此类风险因素。这些风险并不详尽。新的风险因素不时出现,并且Myovant Sciences的管理层无法预测所有风险因素,Myovant Sciences也无法评估所有因素对其业务的影响或任何因素或因素组合的程度,可能导致实际结果与任何前瞻性陈述所包含的结果大不相同。您不应过分依赖本新闻稿中的前瞻性陈述,这些前瞻性陈述仅是截至本新闻稿发布之日,并且,除非法律另有规定,
资料来源:Myovant Sciences,Inc.。
发表于:2020年12月