Veklury瑞德西韦(remdesivir)注射液 FDA批准COVID-19新药上市
- 热度: ℃
- 来源:网络收集
- 收录时间:2020-10-23
导读:Veklury(remdesivir)是SARS-CoV-2核苷酸类似物RNA聚合酶抑制剂,可用于治疗需要住院的COVID-19患者。
Veklury(remdesivir)注射液
公司: Gilead Sciences,Inc
.批准日期: 2020年10月22日
处理: COVID-19
Veklury(remdesivir)是SARS-CoV-2核苷酸类似物RNA聚合酶抑制剂,可用于治疗需要住院的COVID-19患者。
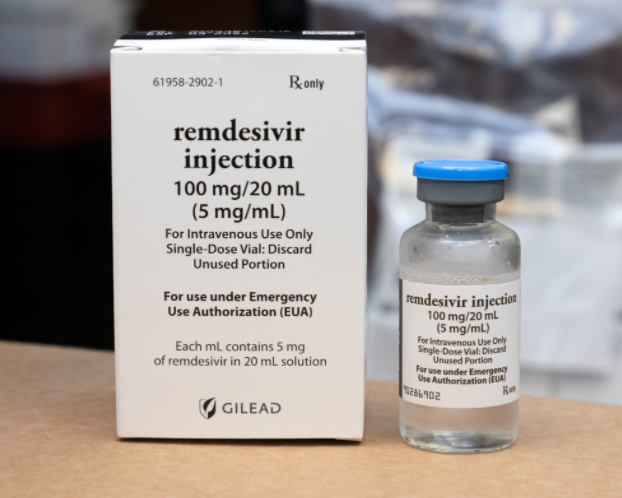
2020年2月22日-Gilead Sciences,Inc.(Nasdaq:GILD)今天宣布,美国食品药品监督管理局(FDA)已批准抗病毒药物Veklury(remdesivir)用于治疗需要住院的COVID-19患者。作为抗病毒药物,Veklury致力于阻止SARS-CoV-2(引起COVID-19的病毒)的复制。Veklury之前已获得FDA批准可紧急用于治疗COVID-19,现在是美国首个也是唯一一个获批的COVID-19治疗。在进行早期投资以迅速扩大生产能力以增加供应之后,该药物现已在全国各地的医院中广泛使用。
在美国,Veklury适用于成人和儿童患者(12岁及以上,体重至少40公斤),用于治疗需要住院的COVID-19。Veklury仅应在能够提供与住院医院护理相当的急性护理的医院或医疗机构中使用。对Veklury或其任何成分过敏的患者禁用Veklury。请参阅以下有关Veklury的其他重要安全信息。
该批准基于三项随机对照试验,包括美国国家过敏和传染病研究所(NIAID)双盲,安慰剂对照的3期ACTT-1试验的最新发表的最终结果,该试验表明Veklury治疗可导致与安慰剂相比,住院的COVID-19患者在多项结果评估中具有临床意义的改善。基于这些数据的优势,Veklury已成为住院患者治疗COVID-19的护理标准。
“ Veklury的批准标志着通过提供有效的治疗方法来帮助解决大流行病的重要里程碑,该方法可以帮助患者更快地康复,从而有助于保留稀缺的医疗资源,” Albert医学教授Barry Zingman医师表示。纽约爱因斯坦医学院和蒙特菲奥雷医学中心。“经过严格测试的治疗方法可以大大加快康复速度,并提供其他好处,例如降低机械通气的进程,为住院患者及其家人提供重要的希望,并为医疗保健提供者提供重要工具,帮助他们护理有需要的患者。 ”
“自从COVID-19大流行开始以来,吉利德一直不懈地努力寻找解决这一全球性健康危机的解决方案。距今天最早的病例报告为COVID-19不到一年的今天,要在美国接受FDA批准的治疗,并为所有有需要的患者提供治疗,真是令人难以置信。”吉利德科学公司董事长兼首席执行官丹尼尔·奥戴说。“ Veklury在美国得到开发和批准的速度和严谨性反映了吉利德,政府机构和临床试验研究人员的共同承诺,即为对抗COVID-19的斗争提供耐受性良好,有效的治疗选择。
在随机,双盲,安慰剂对照的ACTT-1试验中,与安慰剂相比,Veklury的康复时间显着延长-在整个研究人群中缩短了5天(10天vs. 15天;比率为1.29; 95%CI ,在基线时需要氧气支持的患者中,分别为1.12至1.49,p <0.001)和7天(11天对比18天;比率为1.31; 95%CI为1.12至1.52)。作为次要终点,Veklury还减少了需要氧气的患者的疾病进展,从而显着降低了新的机械通气或ECMO的发生率(13%比23%; CI为95%,-15至-4)。在第29天,与安慰剂相比,Veklury的总体患者死亡率有降低的趋势(11.4%比15.2%,HR 0.73; 95%CI,0.52至1.03)。
ACTT-1试验的结果与Veklury在成人中重度和中度COVID-19患者中进行的两项3期开放标签试验的结果相辅相成。在需要补充氧气且没有机械通气的住院患者中进行的SIMPLE-Severe试验发现,Veklury的5天或10天疗程可达到相似的临床结局(几率0.75; 95%CI为0.51至1.12)。在不需要补充氧气的住院患者中进行的SIMPLE-中度试验显示,与标准治疗相比,Veklury为期5天的疗程可显着改善临床结局(赔率1.65; 95%CI为1.09至2.48; p = 0.017)。Veklury的10天疗程与标准护理相比,改善临床状况的几率也不错,
与Veklury相关的不良事件的发生率与ACTT-1试验中的安慰剂相似。与Veklury组相比,安慰剂组的严重不良事件(SAE)发生率更高。各组的治疗中止,全因3级和4级不良事件(AE)和实验室异常相似。在SIMPLE-Severe试验中,Veklury 5天或10天组中至少5%的受试者中最常见的不良反应是恶心(5%vs 3%),AST升高(3%对比6%)和ALT增长(对比2%对比7%)。在SIMPLE-中度试验中,Veklury组中至少5%的受试者中最常见的不良反应是恶心(5天组为7%,10天组为4%)。
在FDA批准Veklury的同时,FDA还发布了一项新的紧急使用授权(EUA),用于使用Veklury来治疗体重不超过3.5千克的12岁以下住院患者或体重不超过3.5千克的住院儿科患者怀疑或实验室确认的COVID-19超过40千克,临床上适合使用静脉(IV)药物。该授权是临时的,可以被撤销,并且不能代替在该患者人群中使用Veklury的正式提交,审查和批准过程。FDA尚未批准在12岁以下或体重不足40公斤的小儿患者中使用Veklury,并且尚未确定Veklury在这种情况下的安全性和有效性。
关于ACTT-1试用
由国家变态反应和传染病研究所(NIAID)赞助的全球,随机,双盲,安慰剂对照的3期临床试验ACTT-1(NTC04280705)评估了Veklury治疗10天疗程的疗效和安全性与接受安慰剂治疗的1,063名已确诊SARS-CoV-2感染,轻度,中度或重度COVID-19的住院成人患者同时接受标准治疗。
ACTT-1的主要结局指标是随机分组后29天内恢复的时间。康复的定义是无活动限制地从医院出院,活动受限和/或需要家庭供氧而从医院出院,或住院但不需要补充氧气且不再需要持续医疗的患者。
关于SIMPLE试用
Gilead在Veklury的两个开放标签的3期临床试验中,在COVID-19感染率很高的国家中进行了试验,其中包括为不同社区服务的美国试验场所。
SIMPLE-Severe临床试验(NCT04292899)是一项随机,开放标签的多中心研究,评估了Veklury的5天和10天给药时间加上标准治疗在397例严重COVID- 19 严重COVID-19的定义为确诊SARS-CoV-2感染,室内空气SpO2≤94%且有肺炎影像学证据的患者。主要终点是第14天的临床状况(按7点顺序评分)。在完成方案定义的治疗时间之前从医院出院的受试者中停止使用Veklury治疗。
SIMPLE-中度试验(NCT04292730)是一项随机,对照,开放标签的多中心研究,评估了Veklury加护理标准与单独使用护理标准相比在5天和10天给药期间的疗效和安全性。 600名中度COVID-19住院成人患者。中度COVID-19定义为确诊的SARS-CoV-2感染,SpO2> 94%和肺炎的放射学证据。主要终点是第11天的临床状况(按7点顺序评分)。
关于维克吕里
Veklury(remdesivir)是吉利德(Gilead)发明的核苷酸类似物,其基础是该公司十多年的抗病毒研究。Veklury在动物模型中具有针对多种新兴病毒病原体(包括埃博拉病毒,SARS,Marburg,MERS和SARS-CoV-2,SARS-CoV-2,引起COVID-19的病毒)的体外和体内广谱抗病毒活性。
Veklury已被批准或授权在全球大约50个国家中暂时用作COVID-19治疗。在我们继续致力于开发有效的COVID-19治疗方法的承诺中,多项正在进行的国际3期临床试验正在评估Veklury在不同患者群体,制剂中以及与其他疗法组合治疗COVID-19的安全性和有效性。
正如2020年10月1日宣布的那样,吉利德现在可以满足美国对Veklury的实时需求,并预计即使在未来可能出现COVID-19激增的情况下,也可以在10月满足全球对Veklury的需求。
美国Veklury重要安全信息
禁忌症
Veklury禁止用于对Veklury或其任何成分有临床显着超敏反应史的患者。
警告和注意事项
超敏反应,包括与输注相关的和过敏反应:在服用Veklury期间和之后,已经观察到超敏反应,包括与输注相关的和过敏反应。在服用Veklury期间和之后,在密切的医学监督下监视患者的超敏反应。症状可能包括低血压,高血压,心动过速,心动过缓,缺氧,发烧,呼吸困难,喘息,血管性水肿,皮疹,恶心,发汗和发抖。较慢的输注速度(最长输注时间≤120分钟)可能会阻止这些反应。如果发生严重的输液相关的超敏反应,请立即中止Veklury并开始适当的治疗(请参阅禁忌症)。
转氨酶升高的风险增加:在健康志愿者和接受Veklury的COVID-19患者中,观察到转氨酶升高。这些升高也被报道为COVID-19的临床特征。对所有患者进行肝实验室检查(请参阅剂量和用法)。如果ALT水平增加到ULN的10倍以上,请考虑停止使用Veklury。如果ALT升高伴有肝脏炎症的体征或症状,请停止VEKLURY。
与氯喹或羟氯喹合用时抗病毒活性降低的风险:由于细胞培养物中存在拮抗作用,因此不建议将VEKLURY与氯喹磷酸酯或羟氯喹硫酸盐并用,可能会导致Veklury的抗病毒活性降低
不良反应
最常见的不良反应(≥5%,所有等级)是恶心。
最常见的实验室异常(所有级别≥5%)是ALT和AST升高。
药物相互作用
Veklury和其他伴随药物的药物相互作用试验尚未在人体中进行。
剂量和给药
剂量:对于≥12岁且体重≥40 kg的成人和儿科患者:第1天为200 mg,然后从第2天起,每天仅通过30到120分钟静脉内输注,每天一次维持剂量100 mg。
治疗时间:对于不需要有创机械通气和/或体外膜氧合(ECMO)的患者:5天;如果未观察到临床改善,则可延长最多5天(总共10天)。对于需要有创机械通气和/或ECMO的患者:10天。
在治疗之前和治疗期间进行测试:在启动Veklury之前和临床使用期间,应进行eGFR,肝实验室和凝血酶原时间测试。
肾功能不全:eGFR <30 mL / min的个体不建议使用Veklury。
剂量准备和给药:请参阅完整的处方信息。
怀孕和哺乳
怀孕:有关怀孕期间使用Veklury的人类数据不足。住院COVID-19的孕妇有发生严重疾病和死亡的风险。仅在潜在利益证明对母亲和胎儿具有潜在风险的情况下,才应在怀孕期间使用Veklury。
哺乳期:尚不知道Veklury是否可以进入母乳。母乳喂养COVID-19的个体应遵循临床指导原则,以避免将婴儿暴露于COVID-19。
美国Veklury指示
Veklury适用于成人和儿童患者(12岁及以上,体重至少40公斤),用于治疗需要住院的COVID-19。Veklury仅应在能够提供与住院医院护理相当的急性护理的医院或医疗机构中使用。
关于吉利德科学
吉利德科学公司(Gilead Sciences,Inc.)是一家以研究为基础的生物制药公司,在医疗需求未得到满足的地区发现,开发和商业化创新药物。该公司致力于改变和简化对世界范围内危及生命的疾病患者的护理。吉利德在全球超过35个国家/地区设有业务部门,总部位于加利福尼亚州的福斯特城。
2023-04-19
瑞德西韦(remdesivir)是一种在研核苷酸类似物,可对抗多种新出现的病毒病原体,在亚太地区,能够采集到至少有27个版本的瑞德西韦。...
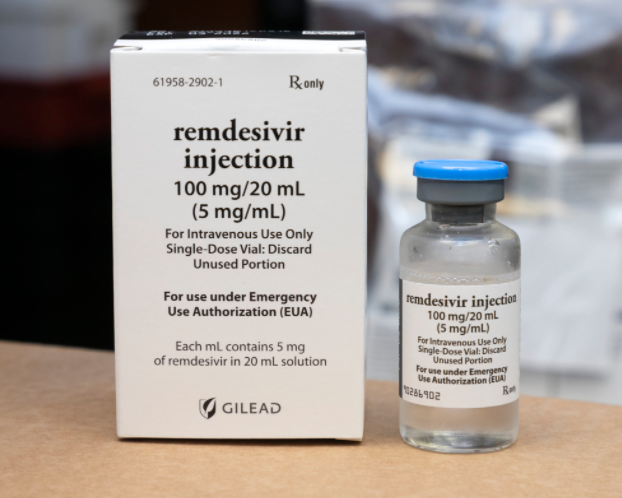
2020-10-24
(FDA)已批准抗病毒药物Veklury 瑞德西韦(remdesivir)用于治疗需要住院的COVID-19患者。作为抗病毒药物,Veklury致力于阻止SARS-CoV-2(引起COVID-19的病毒)的复制。...
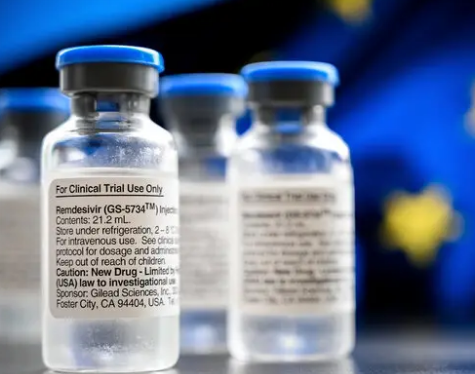
2020-10-23
瑞德西韦(remdesivir)是吉利德(Gilead)发明的核苷酸类似物,其基础是该公司十多年的抗病毒研究。瑞德西韦在动物模型中具有针对多种新兴病毒病原体(包括埃博拉病毒,...
