【资讯导读】Voquezna Dual Pak(阿莫西林和沃诺拉赞)是一种包含阿莫西林(青霉素类抗菌剂)和沃诺拉赞(钾竞争性酸阻滞剂(PCAB))的联合包装产品,适用于治疗成人幽门螺杆菌(H. pylori)感染。
公司: Phathom Pharmaceuticals, Inc.
批准日期: 2022 年 5 月 3 日
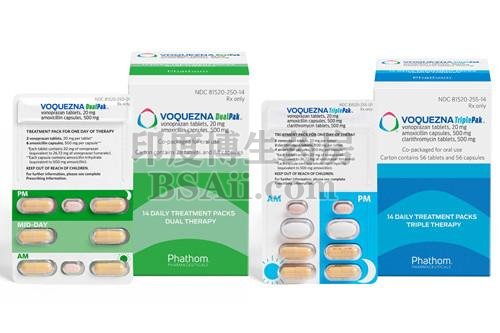
Voquezna Dual Pak(阿莫西林和沃诺拉赞)是一种包含阿莫西林(青霉素类抗菌剂)和沃诺拉赞(钾竞争性酸阻滞剂(PCAB))的联合包装产品,适用于治疗成人幽门螺杆菌(H. pylori)感染。
FDA 批准 Voquezna Triple Pak(沃诺拉赞、阿莫西林、克拉霉素)和 Voquezna Dual Pak(沃诺拉赞、阿莫西林)用于治疗成人幽门螺杆菌感染
Voquezna Triple 和 Dual Paks 均包含 vonoprazan,一种新型的一流钾竞争性酸阻滞剂 (PCAB),在关键的 3 期试验的总体患者群体中,与基于兰索拉唑的三联疗法相比,它们的根除率更高
Voquezna 治疗方案以泡罩包装形式提供,以帮助提高治疗依从性
Voquezna Triple 和 Dual Paks 为医生提供两种不同治疗选择的灵活性,包括不含克拉霉素的治疗方案
预计于 2022 年第三季度在美国进行商业发射
FLORHAM PARK, NJ, May 03, 2022 (GLOBE NEWSWIRE) -- Phathom Pharmaceuticals, Inc. (Nasdaq: PHAT) 是一家专注于开发和商业化胃肠道疾病新疗法的生物制药公司,今天宣布美国食品和药物管理局 (FDA) ) 批准 Voquezna Triple Pak™(沃诺拉赞片剂、阿莫西林胶囊、克拉霉素片剂)和 Voquezna™ Dual Pak™(沃诺拉赞片剂、阿莫西林胶囊)用于治疗幽门螺杆菌(H. pylori )) 成人感染。Voquezna 治疗方案包含方便地与 vonoprazan 包装的抗生素,vonoprazan 是一种新型钾竞争性酸阻滞剂 (PCAB) 和 30 多年来美国批准的新药物类别中的第一个创新酸抑制剂。这些产品的两项新药申请获得了 FDA 的优先审评资格,此前被授予合格传染病产品(QIDP)。
“Voquezna 治疗方案的批准为医生和患者提供了两种治疗选择,在一项关键试验1中,与基于质子泵抑制剂 (PPI) 的兰索拉唑三联疗法相比,它们的根除率更高,”总裁兼总裁 Terrie Curran 说。 Phathom 的首席执行官。“ H. pylori根除率继续下降,部分原因是抗生素耐药性、抑酸不足和复杂的治疗方案2 、3导致患者治疗失败和并发症。需要有可能解决当前治疗局限性的新疗法2,3我们期待着为美国数百万幽门螺杆菌患者带来这些基于沃诺拉赞的创新治疗方案。”
幽门螺杆菌是一种细菌病原体,据估计影响美国近 1.15 亿人,4在过去几十年中,根除率已降至 80% 以下。4如果不及时治疗,幽门螺杆菌感染会导致严重的并发症,例如消化性溃疡病和非贲门
胃癌。5抑酸疗法长期以来一直被确立为H. pylori治疗方案的支柱,以提高抗生素的有效性。3据推测,一种更有效的抑酸剂(如沃诺拉赞)可能有助于提高当前治疗方案的根除率。
“作为一名执业医师,我对两种新型一线幽门螺杆菌治疗方案的潜力感到兴奋,”医学博士、AGAF、FACG、FACP、医学教授兼胃肠病学和
肝病学主任 William D. Chey 说密歇根大学。“我相信增加两种额外有效疗法的灵活性,包括不含克拉霉素的双重疗法,为改善幽门螺杆菌感染患者的临床结果提供了潜力。”
这些批准是基于 PHALCON-HP 3 期试验的安全性和有效性数据,这是美国有史以来在幽门螺杆菌中进行的最大的注册试验,随机分配了 1,046 名患者。1在改良的意向治疗人群中,两种 Voquezna 治疗方案在基线时无克拉霉素或阿莫西林耐药性幽门螺杆菌菌株的患者中均表现出不劣于兰索拉唑三联疗法。幽门螺杆菌_Voquezna Triple Pak 的根除率为 84.7%,而兰索拉唑三联疗法为 78.8% [95% CI:-0.8, 12.6],Voquezna DUAL PAK 为 78.5%,而兰索拉唑三联疗法为 78.8% [95% CI:-7.4, 6.8]。与基于 PPI 的三联疗法(兰索拉唑与阿莫西林和克拉霉素)相比,Voquezna TRIPLE PAK 和 Dual Pak 在所有患者中(包括对克拉霉素耐药的幽门螺杆菌菌株)具有更高的根除率。1在整个研究人群 [95% CI: 5.7, 18.8] 和克拉霉素耐药 H. pylori 菌株的患者中,Voquezna Triple Pak的H. pylori根除率为 80.8%,而兰索拉唑三联疗法为 68.5% ,分别为 65.8% 和 31.9% [95% CI: 17.7, 48.1]。1在整个研究人群中,Voquezna Dual Pak 的H. pylori根除率为 77.2%,而兰索拉唑三联疗法为 68.5% [95% CI:1.9, 15.4] 和克拉霉素耐药H. pylori菌株的患者,为69.6 % 与 31.9% 分别 [95% CI: 20.5, 52.6]。
在试验中,以沃诺拉赞为基础的治疗方案的不良事件 (AE) 发生率与兰索拉唑三联疗法相当。1 Voquezna Triple Pak、Voquezna Dual Pak 和兰索拉唑三联疗法组报告的最常见 AE(> 2.0%)分别为腹泻(4.0%、5.2%、9.6%)、味觉障碍(4.6%、0.6%、 6.1%)、外阴阴道念珠菌病(3.2%、2.0%、1.4%)、腹痛(2.3%、2.6%、2.9%)、头痛(2.6%、1.4%、1.4%)、高血压(2.0%、1.1%、 0.9%)和鼻咽炎(0.3%、2.0%、0.9%)。
完整的处方信息可以在这里找到。
Voquezna Triple 和 Dual Paks 预计将于 2022 年第三季度在美国上市,由 Phathom Pharmaceuticals, Inc. 独家销售。
适应症和重要安全信息
适应症
Voquezna™ Triple Pak™ 是一种联合包装产品,含有一种钾竞争性酸阻滞剂 (PCAB)、阿莫西林(一种青霉素类抗菌剂)和克拉霉素(一种大环内酯类抗菌剂)。Voquezna™ Dual PAK™ 是一种包含沃诺拉赞和阿莫西林的联合包装产品。这两种产品都适用于治疗成人幽门螺杆菌感染。
为了减少耐药细菌的产生并保持 Voquezna Triple Pak、Voquezna Dual Pak 和其他抗菌药物的有效性,这两种产品应仅用于治疗或预防已证实或强烈怀疑由细菌引起的感染。
重要安全信息
禁忌
症 Voquezna Triple Pak 和 Voquezna Dual Pak 禁用于已知对沃诺拉赞或阿莫西林、制剂的任何其他成分、任何其他β-内酰胺类药物过敏的患者,或接受含利匹韦林产品的患者。
由于克拉霉素成分,Voquezna Triple Pak 也禁用于任何已知对克拉霉素或任何大环内酯类抗生素过敏的患者,接受匹莫齐特、洛米他派、洛伐他汀、辛伐他汀、麦角胺、双氢麦角胺、秋水仙碱的患者以及肾或肝功能不全的患者,或有胆汁淤积性黄疸/肝功能障碍病史者。
警告和注意事项
超敏反应:据报道,Voquezna Triple Pak 和 Voquezna Dual Pak 的成分会出现严重和偶尔致命的反应(例如,过敏反应)。如果发生超敏反应,停止使用并立即开始治疗(例如,过敏反应管理)。
严重皮肤不良反应 (SCAR):在出现 SCAR 或其他超敏反应迹象的最初迹象或症状时停止使用 Voquezna Triple Pak 或 Voquezna Dual Pak,并考虑进一步评估。SCAR,包括 Stevens-Johnson 综合征 (SJS) 和中毒性表皮坏死松解症 (TEN) 均已报告与这两种产品的成分有关。此外,据报道,阿莫西林和克拉霉素引起嗜酸性粒细胞增多和全身症状 (DRESS) 和急性泛发性发疹性脓疱病 (AGEP) 的药物反应。
艰难梭菌相关性腹泻 (CDAD):评估是否使用 Voquezna Triple Pak 或 Voquezna Dual Pak 发生腹泻。据报道,CDAD 与抑酸疗法和几乎所有抗菌剂一起使用,其严重程度可能从轻度腹泻到致命性结肠炎不等。如果确诊 CDAD,停止治疗并进行适当治疗。
由于克拉霉素成分引起的 Voquezna Triple Pak 警告或注意事项:
QT 延长:在已知 QT 延长或接受已知延长 QT 间期药物、室性心律失常(尖端扭转型室性心动过速)、低钾血症/低镁血症、显着心动过缓的患者中避免使用 Voquezna Triple Pak,或服用 IA 或 III 类抗心律失常药。
肝毒性:如果出现肝炎的体征和症状,请停止使用 Voquezna Triple Pak。
与其他药物同时使用引起的严重不良反应:由于克拉霉素与秋水仙碱、某些降脂剂、某些钙通道阻滞剂、降血糖剂(包括胰岛素、喹硫平、华法林、苯二氮卓类药物)的药物相互作用,Voquezna Triple Pak 可能会发生严重不良反应。和其他药物。
胚胎-胎儿毒性:不建议在怀孕期间使用 Voquezna Triple Pak,因为克拉霉素可能会对胎儿造成伤害。
重症肌无力: Voquezna Triple Pak 可能会加重重症肌无力,因为在接受克拉霉素片剂的患者中已有报道。
不良反应
最常见的不良反应(≥2%)包括腹泻、味觉障碍、外阴阴道念珠菌病、腹痛、头痛、高血压和鼻咽炎。
药物相互作用
Voquezna Triple Pak 和 Voquezna Dual Pak 的成分具有临床重要药物相互作用的潜力。有关重要的药物相互作用,请参阅完整的处方信息。
在特定人群中使用
哺乳期:不建议在治疗期间进行母乳喂养,但哺乳期妇女可以在治疗期间和 Voquezna Triple Pak 和 Voquezna Dual Pak 给药后 2 天内抽吸和丢弃母乳。
老年病学:Voquezna Triple Pak 因克拉霉素而增加尖端扭转型室速的风险。
肾和肝功能不全:避免用于严重肾功能不全的患者,避免用于中度至重度肝功能不全的患者。
请参阅 Voquezna Triple Pak 和 Voquezna Dual Pak 的完整处方信息。
关于幽门螺杆菌( H. pylori ) 感染
H. pylori是一种细菌病原体,估计在美国感染了近 1.15 亿人。4据估计,全球约 50% 的人口和美国 36% 的人口感染了这种细菌。4由于幽门螺杆菌感染引起的慢性炎症,受感染的患者可能会出现一系列疾病,包括消化不良、消化性溃疡病、非贲门
胃癌和黏膜相关淋巴组织 (MALT)
淋巴瘤。6研究发现,大约四分之一的患者接受幽门螺杆菌治疗当使用基于 PPI 的克拉霉素三联疗法时,一线治疗将失败。
关于 Voquezna Triple 和 Dual Paks
Voquezna Triple PAK(沃诺拉赞、阿莫西林、克拉霉素)和 Voquezna Dual Pak(沃诺拉赞、阿莫西林)含有沃诺拉赞,这是一种与抗生素共同包装的口服小分子钾竞争性酸阻滞剂 (PCAB)。PCAB 是一类新型药物,可阻断胃酸分泌。Vonoprazan 已显示出抑制酸的潜力,可以达到对增强抗生素有效性很重要的 pH 水平。Phathom 从武田获得了 vonoprazan 的美国、欧洲和加拿大权利,该公司完成了 19 个 vonoprazan 的 3 期试验,并在日本和亚洲和拉丁美洲的许多其他国家获得了上市许可。
关于 Phathom Pharmaceuticals, Inc.
Phathom Pharmaceuticals 是一家生物制药公司,专注于开发和商业化治疗胃肠道疾病和病症的新疗法。Phathom 已在美国、欧洲和加拿大获得了 vonoprazan 的独家权利,这是一种一流的钾竞争性酸阻滞剂( PCAB )。基于沃诺拉赞的方案在美国被批准作为联合包装产品的一部分与抗生素联合用于治疗幽门螺杆菌成人感染,以 Voquezna™ Triple Pak™(沃诺拉赞、阿莫西林、克拉霉素)和 Voquezna™ Dual Pak™(沃诺拉赞、阿莫西林)销售。Phathom 已向 FDA 提交了用于治疗糜烂性食管炎( EE )的沃诺拉赞的新药申请,并正在研究使用沃诺拉赞治疗非糜烂性反流病( NERD )。有关 Phathom 的更多信息,请访问公司网站 www.phathompharma.com 并在 LinkedIn 和 Twitter 上关注公司。

