葡萄膜黑色素瘤新药Kimmtrak (tebentafusp-tebn) 注射液FDA获批
- 热度: ℃
- 来源:网络收集
- 收录时间:2022-02-25
导读:Kimmtrak (tebentafusp-tebn) 是一种双特异性 gp100 肽-HLA 导向的 CD3 T 细胞接合剂,适用于治疗 HLA-A*02:01 阳性的患有不可切除或转移性葡萄膜黑色素瘤的成年患者。
公司: Immunocore
批准日期: 2022 年 1 月 25 日
治疗:葡萄膜黑色素瘤
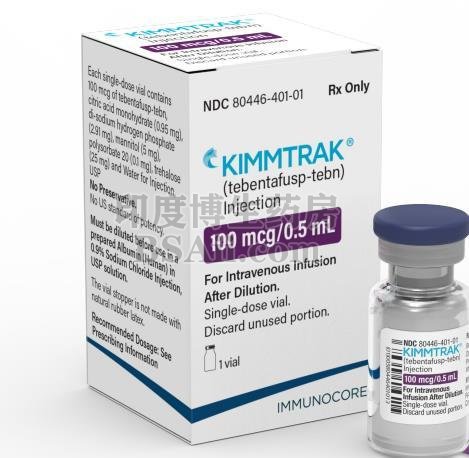
Kimmtrak (tebentafusp-tebn) 是一种双特异性 gp100 肽-HLA 导向的 CD3 T 细胞接合剂,适用于治疗 HLA-A*02:01 阳性的患有不可切除或转移性葡萄膜黑色素瘤的成年患者。
FDA 批准 Kimmtrak (tebentafusp-tebn) 用于治疗不可切除或转移性葡萄膜黑色素瘤
Kimmtrak 是 FDA 批准的第一个也是唯一一个用于治疗不可切除或转移性葡萄膜黑色素瘤 (mUM) 的疗法
Kimmtrak 是第一个获得监管批准的 T 细胞受体 (TCR) 治疗药物
Kimmtrak 显示出具有统计学和临床意义的总体生存 (OS) 益处,风险比为 0.51,中位 OS 接近 22 个月
牛津郡,英格兰和康舒霍肯,宾夕法尼亚。& ROCKVILLE, Md., US,2022 年 1 月 26 日,星期三——Immunocore Holdings plc(纳斯达克股票代码:IMCR)(“Immunocore”或“公司”),一家商业阶段的生物技术公司,率先开发新型 T旨在治疗包括癌症、自身免疫和传染病在内的多种疾病的细胞受体 (TCR) 双特异性免疫疗法今天宣布获得美国食品和药物管理局 (FDA) 批准的Kimmtrak (tebentafusp-tebn) 用于治疗 HLA- A*02:01 阳性成年患者,患有不可切除或转移性葡萄膜黑色素瘤 (mUM)。
Kimmtrak 的批准确立了多项第一,成为第一个获得 FDA 监管批准的 TCR 治疗剂,第一个获得 FDA 监管批准治疗实体瘤的双特异性 T 细胞参与剂,以及第一个也是唯一一个治疗不可切除或转移性的疗法葡萄膜黑色素瘤将获得 FDA 批准。
Immunocore 首席执行官 Bahija Jallal 表示: “今天获得 Kimmtrak 的批准 是一个历史性的里程碑,也是Immunocore团队、患者和我们的医疗保健合作伙伴多年奉献的结晶。在美国,每年都有数百人被诊断出患有转移性葡萄膜黑色素瘤,直到现在他们还没有获得批准的治疗方案。Kimmtrak 是第一个证明对患有这种疾病的患者有生存益处的疗法,我们致力于尽快使Kimmtrak可用。
Jallal 博士表示:“我们也为开发出世界上第一个获批的 TCR 疗法感到自豪,我们相信这验证了我们平台的实力,并为我们探索TCR 疗法治疗其他癌症的进一步突破性发现打开了大门。和高度未满足需求的疾病。”
UPMC Hillman 癌症中心黑色素瘤中心主任、医学博士 John Kirkwood 说:“葡萄膜黑色素瘤是一种毁灭性的疾病,历史上我们的患者在转移后一年内就会死亡。“ Kimmtrak ( tebentafusp -tebn ) 的批准代表了转移性葡萄膜黑色素瘤治疗的重大范式转变,并首次为患有这种侵袭性癌症的人带来了希望。”
Kimmtrak 的批准是基于 Immunocore 的 3 期 IMCgp100-202 临床试验的结果,该结果发表在 2021 年 9 月 23 日的《新英格兰医学杂志》上. 随机关键试验评估了 Kimmtrak 与研究者选择(
派姆单抗、易普利姆玛或达卡巴嗪)在先前未治疗的 mUM 患者中的总生存期(OS)。378 名患者以 2:1 的比例随机分配到 Kimmtrak 或研究者的选择中。该试验是在 mUM 中进行的最大的 3 期试验,其数据显示,Kimmtrak 作为一线治疗显示出前所未有的中位 OS 益处。意向治疗人群的 OS 风险比 (HR) 有利于 Kimmtrak,HR=0.51 (95% CI: 0.37, 0.71);p < 0.0001,超过研究者的选择(82%
派姆单抗;13% 易普利姆玛;6% 达卡巴嗪)。在临床试验中,两组患者均因疾病进展停止治疗,除非患者获得其他益处或出现不可接受的毒性。
“当我的丈夫 Gregg 被诊断出患有转移性葡萄膜黑色素瘤时,得知没有任何治疗方案可以延长生命时,我感到非常沮丧。” Sara Selig 医学博士、公共卫生硕士、黑色素瘤研究基金会(MRF) CURE OM 计划的联合创始人兼主任说。“现在,在这种疾病的历史上,我们将很快看到 下一代转移性葡萄膜黑色素瘤患者的生存期延长。”
在 Kimmtrak (tebentafusp-tebn) 的随机 3 期试验中,治疗相关的不良反应是可控的,并且与提议的机制一致。在接受 Kimmtrak 治疗的患者中,最常见的 3 级或更高级别的不良反应是皮疹 (18%)、发热 (4%) 和瘙痒 (5%)。在接受 Kimmtrak 治疗的 245 名患者中,3 级细胞因子释放综合征 (CRS) 发生在 <1% 的患者中,并且通常得到良好管理。在 3 期试验中没有观察到 4 级或致命的 CRS 事件。CRS 包括一个黑框警告,因为如果管理不当,它有可能变得严重或危及生命。
“到目前为止,转移性葡萄膜黑色素瘤患者的有效治疗方案几乎不存在。Kimmtrak 的批准不仅代表了一种新的治疗方法,而且对被诊断出患有最致命眼癌的个人和家庭带来了新的希望,” MRF首席执行官 MBA凯莉·利皮拉 ( Kyleigh LiPira )说。
该公司已准备好将 Kimmtrak 商业化,并预计将在几周内使该产品在美国商业化。
Kimmtrak 于 2021 年 2 月被 FDA 授予不可切除或转移性葡萄膜黑色素瘤的突破性治疗指定。生物制品许可申请 (BLA) 的批准是在实时
肿瘤学审查 (RTOR) 计划的审查之后进行的,这是 FDA
肿瘤学卓越中心的一项倡议旨在为患者有效地提供安全有效的癌症治疗。该批准在指定的 PDUFA 日期 2022 年 2 月 23 日之前四个星期获得批准。 Immunocore 提供了评估 AID 以促进 FDA 审查。Kimmtrak 正在 FDA 的 Orbis 计划下进行审查,该计划使要求参与的伙伴国家的卫生当局能够同时进行审查。
欧洲药品管理局(EMA)、英国药品和医疗保健监管机构(MHRA)、加拿大卫生部和澳大利亚政府卫生治疗用品管理局(TGA)已接受公司提交的上市许可申请。此外,Immunocore 启动了一项全球早期访问计划,以使 mUM 患者可以随时使用 Kimmtrak。目前有 13 个国家的 200 多名患者参与了早期访问计划。
Immunocore 致力于帮助需要 Kimmtrak 的患者通过其 KimmtrakConnect 计划获得访问权。该计划由专门的护士个案经理提供服务,他们提供个性化的支持,包括教育资源、经济援助和护理协调场所。要了解更多信息,请访问本周晚些时候推出的 KimmtrakConnect.com,或致电 844-775-CARE (2273)。
关于葡萄膜黑色素瘤
葡萄膜黑色素瘤是一种罕见的侵袭性黑色素瘤,会影响眼睛。虽然它是成人最常见的原发性眼内恶性肿瘤,但诊断很少见,高达 50% 的葡萄膜黑色素瘤患者最终会发展为转移性疾病。不可切除或转移性葡萄膜黑色素瘤通常预后不良,直到 Kimmtrak 才获得批准的治疗。
关于Kimmtrak ®
Kimmtrak 是一种新型双特异性蛋白,由融合了抗CD3 免疫效应功能的可溶性T 细胞受体组成。Kimmtrak 专门针对 gp100,一种在黑色素细胞和黑色素瘤中表达的谱系抗原。这是第一个使用 Immunocore 的 ImmTAC 技术平台开发的分子,旨在重定向和激活 T 细胞以识别和杀死肿瘤细胞。Kimmtrak 已获得美国 FDA 授予的突破性治疗指定、快速通道指定和孤儿药指定、EMA 加速评估以及英国转移性葡萄膜黑色素瘤早期获取药物计划下的有希望的创新药物( PIM )指定。
关于第三阶段IMCgp100-202试验
IMCgp100-202 (NCT03070392) 是一项随机关键试验,在 HLA-A*02:01 阳性成人患者中评估 Kimmtrak (tebentafusp-tebn) 与研究者选择(派姆单抗、易普利姆玛或达卡巴嗪)的总生存期 (OS)以前未经治疗的 mUM 患者。在有利于 Kimmtrak 的意向治疗人群中,Kimmtrak 展示了前所未有的 OS 益处和风险比 (HR),HR=0.51 (95% CI: 0.37, 0.71);p < 0.0001,超过研究者的选择(82% 派姆单抗;13% 易普利姆玛;6% 达卡巴嗪)。
重要安全信息
细胞因子释放综合征 (CRS)可能严重或危及生命,发生在接受Kimmtrak 的患者中。在前 3 次输注后监测至少 16 小时,然后根据临床指示进行监测。CRS 的表现可能包括发烧、低血压、缺氧、寒战、恶心、呕吐、皮疹、转氨酶升高、疲劳和头痛。接受 Kimmtrak 的患者中有 89% 发生 CRS,其中 0.8% 为 3 级或 4 级。确保立即获得药物和复苏设备来管理 CRS。确保患者在开始输注之前血容量正常。密切监测患者输注 Kimmtrak 后 CRS 的体征或症状。监测液体状态、生命体征和氧合水平并提供适当的治疗。根据 CRS 的持续性和严重程度,扣留或终止 Kimmtrak。
皮肤反应
91% 的接受 Kimmtrak 治疗的患者出现皮肤反应,包括皮疹、瘙痒和皮肤水肿。监测患者的皮肤反应。如果发生皮肤反应,根据症状的持续性和严重程度,使用抗组胺药和局部或全身类固醇治疗。根据皮肤反应的严重程度,扣留或永久停用 Kimmtrak。
肝酶升高
接受 Kimmtrak 治疗的患者中有 65% 出现肝酶升高。在开始使用 Kimmtrak 治疗之前和期间监测丙氨酸氨基转移酶 (ALT)、天冬氨酸氨基转移酶 (AST) 和总血胆红素。根据严重程度扣留Kimmtrak。
胚胎-胎儿毒性
Kimmtrak 可能对胎儿造成伤害。建议对胎儿有潜在风险的妊娠患者和有生殖潜力的患者在用 Kimmtrak 治疗期间和最后一次给药后 1 周使用有效的避孕措施。
接受 Kimmtrak 的患者最常见的不良反应 (≥30%) 是细胞因子释放综合征、皮疹、发热、瘙痒、疲劳、恶心、寒战、腹痛、水肿、低血压、皮肤干燥、头痛和呕吐。最常见(≥50%)的实验室异常是淋巴细胞计数减少、肌酐升高、葡萄糖升高、AST 升高、ALT 升高、血红蛋白降低和磷酸盐降低。
关于KimmtrakConnect Immunocore
致力于帮助需要 Kimmtrak 的患者通过我们的 KimmtrakConnect 计划获得访问权。该计划由专门的护士个案经理提供服务,他们提供个性化的支持,包括教育资源、经济援助和护理协调场所。要了解更多信息,请访问 KimmtrakConnect.com 或致电 844-775-2273。
关于ImmTAC ® Molecules
Immunocore的专有 T 细胞受体 (TCR) 技术产生了一类新型的双特异性生物制剂,称为 ImmTAC(免疫动员单克隆 TCR 抗癌)分子,旨在重定向免疫系统以识别和杀死癌细胞。ImmTAC 分子是可溶性 TCR,被设计用于以超高亲和力识别细胞内癌症抗原,并通过抗 CD3 免疫激活效应功能选择性地杀死这些癌细胞。基于已证实的 T 细胞浸润人类肿瘤的机制,ImmTAC 的作用机制具有治疗血液肿瘤和实体肿瘤的潜力,无论突变负荷或免疫浸润如何,包括免疫“冷”低突变率肿瘤。
关于免疫核心
Immunocore 是一家商业阶段的生物技术公司,率先开发了一种名为 ImmTAX 的新型 TCR 双特异性免疫疗法——免疫动员单克隆 TCR 对抗 X 疾病——旨在治疗广泛的疾病,包括癌症、自身免疫和传染病。利用其专有的、灵活的、现成的 ImmTAX 平台,Immunocore 正在多个治疗领域开发一条深入的管道,包括肿瘤学和传染病的五个临床阶段项目、自身免疫性疾病的先进临床前项目和多个早期临床前项目程式。Immunocore最先进的肿瘤TCR疗法Kimmtrak(tebentafusp-tebn)已获美国FDA批准用于治疗HLA-A*02: