FDA批准Bylvay(odevixibat) 用于治疗进行性家族性肝内胆汁淤积症 (PFIC) 患者
- 热度: ℃
- 来源:网络收集
- 收录时间:2021-07-26
导读:Bylvay (odevixibat) 是一种回肠胆汁酸转运 (IBAT) 抑制剂,用于治疗 3 个月及以上进行性家族性肝内胆汁淤积症 (PFIC) 患者的瘙痒。
公司: Albireo Pharma, Inc.
批准日期: 2021 年 7 月 20 日
治疗:进行性家族性肝内胆汁淤积症 (PFIC)
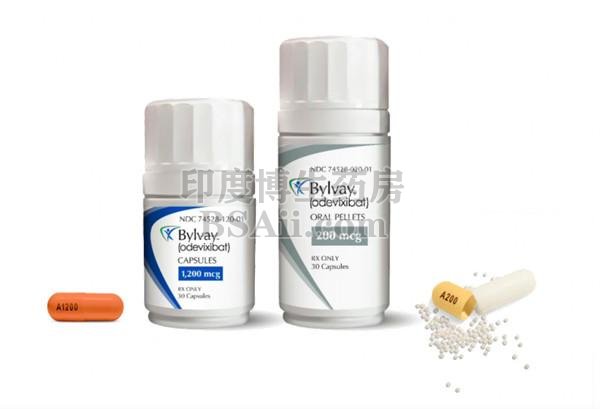
Bylvay (odevixibat) 是一种回肠胆汁酸转运 (IBAT) 抑制剂,用于治疗 3 个月及以上进行性家族性肝内胆汁淤积症 (PFIC) 患者的瘙痒。
(FDA) 批准了 Bylvay (odevixibat) ,第一种被批准用于治疗所有亚型进行性家族性肝内胆汁淤积症(PFIC)瘙痒的药物。Bylvay 是一种有效的非全身性回肠胆汁酸转运抑制剂 (IBATi),不需要冷藏,每天服用一次胶囊,或打开后洒在软食物上,很容易服用。Albireo 将立即启动 Bylvay,以加快受 PFIC 影响的患者和家庭的可用性。
“鉴于目前的治疗方案,治疗患有 PFIC 的儿童可能很困难,也很令人沮丧。Bylvay 为我们提供了一个非手术选择,并将改变我们治疗 PFIC 的方式,”伦敦国王学院分子
肝病学教授兼 PEDFIC 1 和 PEDFIC 2 的首席研究员 Richard Thompson 说。“有了这项批准,我和我的同事现在有了有机会重新审视 PFIC 患者的管理方式,我们希望这些孩子能获得更好的结果。”
PFIC 是一种罕见且具有破坏性的疾病,会影响幼儿,导致进行性的、危及生命的
肝病。在许多情况下,PFIC 会在生命的前 10 年内导致肝硬化和肝功能衰竭。PFIC 最突出和最有问题的持续表现是瘙痒或剧烈瘙痒,这通常会导致生活质量严重下降。到目前为止,还没有批准用于 PFIC 的药物。只有包括胆道改道手术 (BDS) 和肝移植在内的手术选择可用,没有它们,大多数 PFIC 患者活不过 30 岁。估计有 100,000 名胆汁淤积性肝病患者未经批准的药物治疗。在这些患者中,大约有 15,000 名 PFIC(不包括中国和印度)。
Bylvay 的批准得到了 PEDFIC 1 和 PEDFIC 2 数据的支持,PEDFIC 1 和 PEDFIC 2 是 PFIC 有史以来最大的、全球性的、3 期试验。在 PEDFIC 1(一项随机、双盲、安慰剂对照研究)中,Bylvay 达到了瘙痒 (p=0.004) 和血清胆汁酸 (p=0.003) 的主要终点,并且耐受性良好,腹泻/频繁肠道的发生率非常低运动(治疗患者的 9.5% 与安慰剂患者的 5.0%)。PEDFIC 2 是一项长期、开放标签的 3 期扩展研究,重申了 Bylvay 持续降低了血清胆汁酸,并改善了治疗长达 48 周的患者的瘙痒评估、生长和其他肝功能标志物。在两项研究中,Bylvay 的耐受性良好,腹泻/频繁大便是最常见的治疗相关胃肠道不良事件。
Albireo 总裁兼首席执行官 Ron Cooper 说:“ Bylvay 是 FDA 有史以来第一个批准为小儿胆汁淤积性肝病开发的药物,并为患有 PFIC 负担的患者提供非手术治疗。“我们为儿童、家庭和研究人员感到谦卑,他们对我们的临床试验的承诺将为这么多未来的患者带来希望和治疗益处。”
为 Bylvay 发布做好准备
预计将在未来几天内完成包装和发货。随着 Bylvay 的立即推出,Albireo 已准备好专注于获取和报销、促销和患者支持。为了支持付款人的决策,Albireo 提交了一份具有吸引力的价值包,其中包含 PEDFIC、黄金标准、第 3 阶段数据,其中包括患者用药两年以上的长期数据;自然历史信息;和照顾者研究以反映 PFIC 的负担。
促销活动将立即开始。Albireo 和 Travere Therapeutics 的销售代表将迅速覆盖 60 个主要中心,向他们通报 Bylvay 可用于治疗 PFIC 中的瘙痒症和患者访问服务。
一旦开出了 Bylvay,HCP 和家属将可以选择使用 Albireo Assist™,这是一个定制的患者支持计划,根据患者倡导者的意见建立。该计划的特色是 Albireo 雇用的专门的美国区域护理协调员,他们将调查福利并审查经济援助选项,以帮助确保最佳的患者访问。他们还将积极协助促进剂量变化、实验室工作、补充提醒、重新授权和其他活动。
Bylvay 是 Albireo 在美国的第一种市售药物。经美国批准,FDA 发布了罕见儿科疾病优先审查券 (PRV),公司计划将其货币化。截至 2021 年 6 月 30 日(未经审计),公司的现金和现金等价物为 1.863 亿美元,预计 2021 年的运营现金消耗将在 1.30-1.35 亿美元之间。不包括计划出售 PRV 的任何收益,公司认为其现金和现金等价物将满足其到 2023 年的运营费用和资本支出需求,这应该足以启动 Bylvay 并扩展到 PFIC 之外。
Albireo 还在研究 Bylvay 在其他罕见的小儿胆汁淤积性肝病中的应用,包括针对胆道闭锁患者的 BOLD 3 期临床试验和针对 Alagille 综合征的 ASSERT 3 期临床试验。ASSERT 试验的顶线数据预计在 2022 年公布,BOLD 试验预计在 2024 年公布。
关于 Bylvay (odevixibat)
Bylvay 是美国首个获批用于治疗所有亚型进行性家族性肝内胆汁淤积症 (PFIC) 瘙痒的药物。Bylvay 是一种有效的、每日一次的非全身性回肠胆汁酸转运抑制剂,在小肠局部起作用。Bylvay 不需要冷藏,可以作为年龄较大的儿童服用的胶囊,或打开后洒在食物上,这些是儿科患者依从性的关键因素。
Bylvay 的推荐剂量为 40 mcg/kg,每天早上随餐服用一次。如果三个月后临床反应不足,剂量可以以 40 mcg/kg 的增量增加至 120 mcg/kg,每天一次,但不超过每日总剂量 6 mg。该药物只能通过处方获得,治疗应由具有 PFIC 管理经验的医生开始和监督。有关使用 Bylvay 的更多信息,请参阅包装说明书或联系您的医生或药剂师。
欧盟委员会 (EC) 已授予 Bylvay 在 PFIC 的营销授权,并将在定价和报销批准后在欧洲销售。Bylvay 获得孤儿药资格,用于治疗 Alagille 综合征、胆道闭锁和原发性胆汁性胆管炎。Bylvay 正在接受针对 PFIC 患者的 PEDFIC 2 开放标签试验、针对胆道闭锁患者的 BOLD 3 期研究和针对 Alagille 综合征的 ASSERT 3 期研究进行评估。
关于PFIC
进行性家族性肝内胆汁淤积症 (PFIC) 是一种罕见的疾病,可导致进行性、危及生命的肝脏疾病。患者因基因突变而导致胆汁流动受损或胆汁淤积。由此产生的肝细胞中的胆汁积聚会导致肝脏疾病和症状。该疾病最突出和最有问题的持续表现是瘙痒或剧烈瘙痒,这通常会导致生活质量严重下降。其他症状包括黄疸、体重增加缓慢和生长缓慢。在许多情况下,PFIC 会在生命的前 10 年内导致肝硬化和肝功能衰竭,几乎所有 PFIC 患者都需要在 30 岁之前接受治疗。 到目前为止,目前还没有批准用于 PFIC 的药物,只有包括部分外部胆道改道 (PEBD) 和肝移植。
关于 AlbireoAssist™
AlbireoAssist 旨在帮助患者和家属获得 Bylvay 的治疗。该计划设有专门的区域护理协调员,以主动协助剂量变化、实验室工作、补充提醒、重新授权和其他活动。护理协调员还将帮助调查福利并审查经济援助选项。
关于 Albireo
Albireo Pharma 是一家罕见疾病肝脏公司,专注于开发新型胆汁酸调节剂以治疗罕见的儿科和成人肝脏疾病。Albireo 的主要候选产品 Bylvay 被美国 FDA 批准为第一个用于治疗所有亚型进行性家族性肝内胆汁淤积症(PFIC)患者的瘙痒症,同时也被开发用于治疗其他罕见的小儿胆汁淤积性肝病Alagille 综合征和胆道闭锁的 3 期试验,以及 PFIC 的开放标签扩展 (OLE) 研究。在欧洲,Bylvay 已被批准用于治疗 PFIC,并已提交定价和报销批准。公司还启动了 A3907 的 1 期临床试验,以推进成人胆汁淤积性肝病的开发,随着 A2342 用于病毒性和胆汁淤积性肝病的 IND 支持研究向前推进。Albireo 于 2008 年从阿斯利康分拆出来,总部位于马萨诸塞州波士顿,其主要运营子公司位于瑞典哥德堡。《波士顿商业杂志》连续第二年将 Albireo 评为马萨诸塞州 2020 年最佳工作场所之一。