急性淋巴细胞白血病新药Rylaze(天冬酰胺酶菊花(重组)-rywn)注射液
- 热度: ℃
- 来源:网络收集
- 收录时间:2021-07-02
导读:Rylaze(天冬酰胺酶 erwinia chrysanthemi (recombinant)-rywn)是一种天冬酰胺特异性酶,被指定为用于治疗急性淋巴细胞白血病 (ALL) 和淋巴细胞淋巴瘤 (LBL) 的多药化疗方案的组成部分。
公司: Jazz Pharmaceuticals plc
批准日期: 2021 年 6 月 30 日
治疗:急性淋巴细胞白血病
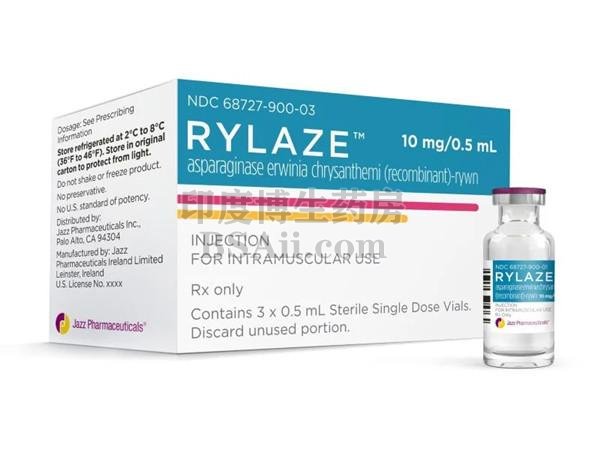
Rylaze(天冬酰胺酶 erwinia chrysanthemi (recombinant)-rywn)是一种天冬酰胺特异性酶,被指定为用于治疗急性淋巴细胞白血病 (ALL) 和淋巴细胞淋巴瘤 (LBL) 的多药化疗方案的组成部分。
美国食品药品监督管理局(FDA)批准 Rylaze(天冬酰胺酶菊花(重组)-rywn)用作多药化疗方案,用于治疗对大肠杆菌衍生的天冬酰胺酶过敏的 1 个月及以上儿童和成人患者的急性淋巴细胞白血病 (ALL) 或淋巴细胞
淋巴瘤 (LBL) 。1Rylaze 是唯一一种在整个治疗期间保持具有临床意义的天冬酰胺酶活性水平的重组欧文尼亚天冬酰胺酶制造产品,它由 Jazz 开发,旨在满足患者和医疗保健提供者的需求,提供创新的高质量欧文尼亚衍生产品供应可靠的天冬酰胺酶。
“我们很高兴将这种重要的新疗法带给急需的患者,我们感谢 FDA 基于其既定的安全性和有效性特征批准 Rylaze。我们很高兴 Rylaze 在试验完成之前获得批准,并且Jazz Pharmaceuticals 董事长兼首席执行官 Bruce Cozadd 表示:“我们正在努力推进更多的临床试验数据。我们致力于快速与 FDA 合作,通过更多的剂量选择和静脉给药途径来改进 Rylaze 产品概况。” “感谢我们在儿童
肿瘤学小组内的合作者、临床试验研究人员、患者及其家人,以及帮助我们实现这一重要里程碑的所有其他利益相关者。”
Rylaze 于 2021 年 6 月被 FDA 授予治疗 ALL/LBL 的孤儿药指定。 生物制剂许可申请(BLA)批准后根据实时
肿瘤学审查(RTOR)计划进行审查,这是 FDA 肿瘤学卓越中心的一项计划为患者提供安全有效的癌症治疗。
公司预计 Rylaze 将于 7 月中旬上市。
“Rylaze 的加速开发和批准标志着为许多 ALL 患者(其中大多数是儿童)带来有意义的新治疗选择迈出了重要的一步,这些患者不能耐受 大肠杆菌衍生的天冬酰胺酶药物,”助理教授 Luke Maese 博士说在犹他大学、初级儿童医院和亨斯迈癌症研究所。“在 Rylaze 获得批准之前,非常需要一种有效的天冬酰胺酶药物,使患者能够在供应充足的情况下开始和完成他们规定的治疗计划。”
来自儿童肿瘤学组对 8,000 多名患者的回顾性分析的最新数据发现,由于相关毒性而未接受完整天冬酰胺酶治疗的患者的生存结果显着降低——无论这些患者是高风险还是标准风险,早期缓慢响应者。2
关于研究 JZP458-201
FDA 对 Rylaze(也称为JZP458)的批准基于一项正在进行的关键性 2/3 期单臂、开放标签、多中心、剂量确认研究的临床数据,该研究评估了患有 ALL 或对大肠杆菌有过敏反应的 LBL -衍生的天冬酰胺酶,并且以前没有接受过天冬酰胺酶 erwinia chrysanthemi。该研究旨在评估 JZP458 的安全性、耐受性和有效性。通过血清天冬酰胺酶活性(SAA)水平测量功效的测定。2/3 期研究分两部分进行。第一部分是研究肌内 (IM) 给药途径,包括周一至周三至周五的给药时间表。第二部分仍然有效,以进一步确认静脉 (IV) 给药途径的剂量和时间表。
FDA 批准 Rylaze 是基于三个 IM 队列中第一个队列的数据,该数据表明使用 IM 剂量的 48 小时达到和维持最低血清天冬酰胺酶活性 (NSAA) 大于或等于 0.1 U/mL 的水平Rylaze 25 毫克/平方米。建模和模拟结果显示,对于每 48 小时肌肉注射 25 mg/m2 的剂量,在服用 Rylaze 后 48 小时维持 NSAA ≥ 0.1 U/mL 的患者比例为 93.6%(95% CI:92.6 %, 94.6%)。1
最常见的不良反应(发生率 >15%)是肝功能检查异常、恶心、肌肉骨骼疼痛、疲劳、感染、头痛、发热、药物过敏、发热性中性粒细胞减少、食欲下降、口腔炎、出血和高血糖。在接受 Rylaze 治疗的患者中,一名患者发生了致命的不良反应(感染),55% 的患者发生了严重的不良反应。最常见的严重不良反应(≥5% 的患者)是发热性中性粒细胞减少症、脱水、发热、口腔炎、腹泻、药物过敏、感染、恶心和病毒感染。9% 接受 Rylaze 的患者因不良反应而永久停药。导致永久停药的不良反应包括超敏反应 (6%) 和感染 (3%)。1
该公司将继续与 FDA 合作,并计划提交完整的患者队列的额外数据,评估周一和周三给予的 25mg/m2 IM 以及周五给予的 50mg/m2 以支持 M/W/F 给药时间表. 该研究的第 2 部分正在评估 IV 给药,并且正在进行中。该公司还计划在未来的医学会议上提交这些数据。
关于 Rylaze(天冬酰胺酶 erwinia chrysanthemi (recombinant)-rywn)
Rylaze,也称为 JZP458,在美国被批准用作治疗急性淋巴细胞白血病 (ALL) 或淋巴细胞淋巴瘤的多药化疗方案的组成部分。 LBL) 用于对大肠杆菌产生超敏反应的 1 个月及以上的儿童和成人患者 -衍生的天冬酰胺酶。Rylaze 在美国被指定为治疗 ALL/LBL 的孤儿药。Rylaze 是一种重组 erwinia 天冬酰胺酶,它使用新型荧光假单胞菌表达平台。JZP458 于 2019 年 10 月获得美国食品和药物管理局 (FDA) 的快速通道指定,用于治疗该患者群体。Rylaze 被批准为实时肿瘤学审查计划的一部分,该计划是 FDA 肿瘤学卓越中心的一项举措,旨在为患者有效提供安全有效的癌症治疗。
重要安全信息
Rylaze 不应该给有以下情况的人:
对 Rylaze 的严重过敏反应
在之前的天冬酰胺酶治疗期间胰腺严重肿胀(胃痛)、严重血栓或严重出血
Rylaze 可能会导致严重的副作用,包括:
过敏反应(喉咙发紧感,喉咙和/或舌头异常肿胀/发红,或呼吸困难),其中一些可能危及生命
胰腺肿胀(胃痛)
血栓(可能有头痛或腿部、手臂或胸部疼痛)
流血
肝脏问题
如果出现任何这些副作用,请立即联系您的医生。
Rylaze 最常见的一些副作用包括:肝脏问题、恶心、骨骼和肌肉疼痛、疲倦、感染、头痛、发烧、过敏反应、白细胞计数低的发烧、食欲下降、口腔肿胀(有时伴有溃疡) ,出血,血液中的糖分过多。
Rylaze 会伤害您未出生的婴儿。如果您怀孕、计划怀孕或哺乳,请告知您的医生。有生育潜力的女性在治疗期间和最后一次给药后 3 个月内应使用有效的避孕措施(口服避孕药除外)。在接受 Rylaze 期间和最后一次给药后 1 周内不要进行母乳喂养。
如果有任何令人烦恼或不会消失的副作用,请告诉您的医疗保健提供者。
这些并不是 Rylaze 的所有可能的副作用。如需更多信息,请咨询您的医疗保健提供者。
关于 ALL
ALL 是一种血液和骨髓癌,如果不治疗,会迅速进展。3 白血病是儿童中最常见的癌症,其中大约四分之三的病例是 ALL。4 尽管 ALL 是儿童中最常见的癌症之一,但由于最近治疗方法的进步,ALL 是最可治愈的儿科恶性肿瘤之一。5,6 成人也可发展为 ALL,每 10 例确诊的 ALL 病例中约有 4 例为成人。7 美国癌症协会估计,到 2021 年,美国将诊断出近 6,000 例新的 ALL 病例。7 天冬酰胺酶是 ALL 多药化疗方案的核心组成部分。8 然而,源自大肠杆菌的天冬酰胺酶治疗 与发生超敏反应的可能性有关。9
关于淋巴瘤
细胞淋巴瘤LBL 是一种罕见的、快速生长的、侵袭性的非霍奇金淋巴瘤亚型,最常见于青少年和年轻人。8 LBL 是一种侵袭性很强的淋巴瘤——也称为高级别淋巴瘤——这意味着淋巴瘤生长迅速,早期扩散到身体的不同部位。10,11
关于 Jazz Pharmaceuticals plc
Jazz Pharmaceuticals plc(纳斯达克股票代码:JAZZ)是一家全球生物制药公司,其宗旨是通过创新来改变患者及其家人的生活。我们致力于为患有严重疾病的人开发改变生活的药物 - 通常治疗选择有限或没有。我们在神经科学和肿瘤学领域拥有多样化的上市药物和新型候选产品组合,从早期到后期开发。我们积极为患者探索新的选择,包括新型化合物、小分子和生物制剂,并通过大麻素科学和创新的递送技术。Jazz 总部位于爱尔兰都柏林,员工遍布全球,为近 75 个国家/地区的患者提供服务。