阵发性夜间血红蛋白尿新药Empaveli(pegcetacoplan)注射剂FDA获批
- 热度: ℃
- 来源:网络收集
- 收录时间:2021-05-17
导读:Empaveli(pegcetacoplan)是用于治疗阵发性夜间血红蛋白尿(PNH)的靶向C3抑制剂。
公司: Apellis Pharmaceuticals,Inc
.批准日期: 2021年5月14日
治疗:阵发性夜间血红蛋白尿
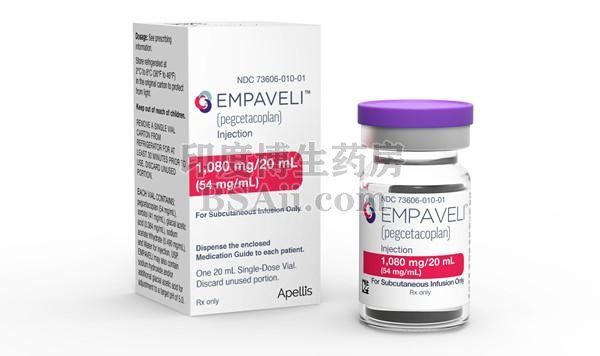
Empaveli(pegcetacoplan)是用于治疗阵发性夜间血红蛋白尿(PNH)的靶向C3抑制剂。
美国食品药品监督管理局(FDA)已批准的Empaveli ™(pegcetacoplan),这是第一种也是唯一一种针对成人阵发性夜间血红蛋白尿(PNH)的靶向C3治疗。Empaveli被批准用于初治的PNH成人以及从C5抑制剂Soliris®(依库珠单抗)和Ultomiris®(ravulizumab)换药的患者。
“ Empaveli有潜力通过增加血红蛋白和减少输血来改善PNH患者的生活,” PEGASUS研究研究员,血液学和
肿瘤学系医学副教授Robert H博士Olga Frankfurt博士说。西北大学卢里综合癌症中心。“通过作为PEGASUS研究的调查员,我很高兴看到Empaveli提供了对PNH的广泛控制。”
“作为首个获得FDA批准的靶向C3治疗药物,Empaveli有潜力重新定义针对PNH成人的治疗方法,包括从任何C5抑制剂和未接受过治疗的患者中转出的患者。感谢您的临床试验参与者,PNH社区,研究人员,医疗保健专业人员,SFJ Pharmaceuticals,以及为这一重要里程碑做出贡献的其他人。” Apellis联合创始人兼首席执行官Cedric Francois博士说。 。“该批准代表了一项重大的科学进步,因为Empaveli迎来了近15年以来的第一类新型补体医学。我们期待着探索靶向C3的全部潜力,并继续推进该疗法的注册计划,以解决那些需求高度未得到满足的多种补体驱动性疾病。”
Empaveli的批准基于PEGASUS第3阶段面对面研究的结果,该结果最近发表在《新英格兰医学杂志》上。在PEGASUS研究中,Empaveli达到了主要终点,表明在第16周时血红蛋白水平相对于基线水平的变化优于Soliris,调整后的血红蛋白平均增加3.84 g / dL(p <0.0001)。此外,在避免输血的终点上,Empaveli与Soliris相比具有非自卑感。在Empaveli治疗的患者中,有85%的患者在16周内无输血,而在Soliris治疗的患者中,这一比例为15%。
“我们很高兴听到FDA批准Empaveli的决定,这对患者来说是一个重要的里程碑,”再生障碍性贫血和MDS国际基金会(AAMDSIF)首席执行官兼执行董事Janice Frey-Angel说。“许多PNH患者正在寻求治疗选择,因此批准为PNH社区带来了新希望。”
Empaveli的处方信息包含一个带框的警告。Empaveli可能会增加由包膜细菌引起的脑膜炎球菌和其他严重感染的风险,这些细菌如果不及早发现和治疗,可能会迅速威胁生命或致命。FDA已为Empaveli批准了风险评估和缓解策略(REMS)。处方者必须为患者提供有关严重感染风险的建议,向患者提供REMS教育材料,并确保患者接种了包封细菌。
用Empaveli治疗的患者中最常见的严重不良反应是感染(5%)。Empaveli最常见的不良反应(≥10%)是注射部位反应(39%),感染(29%),腹泻(22%),腹痛(20%),呼吸道感染(15%),病毒感染(12%)和疲劳(12%)。Empaveli治疗的患者无脑膜炎病例,无死亡报告。
PNH是一种罕见的,慢性的,危及生命的血液疾病,由获得性突变引起,它导致不受控制的补体激活以及通过血管内和血管外溶血作用破坏红细胞。根据对C5抑制剂治疗的患者的回顾性和横断面研究,至少72%的患者血红蛋白1,2 持续低下,至少36%的患者每年需要输血一次或多次。1个
Apellis致力于帮助患者获得治疗机会和支持。ApellisAssist™是一项旨在为Empaveli患者在整个治疗过程中提供全面产品支持的计划。该计划为符合条件的患者提供服务和产品资源,包括保险支持,教育,培训以及经济援助。患者和医疗保健提供者可以联系1-866-692-7527以获取更多信息。
欧洲药品管理局正在审核培格他克计划治疗PNH的销售授权申请,并有可能在2021年下半年做出欧洲委员会的决定。
关于PEGASUS研究
PEGASUS研究(APL2-302; NCT03500549)是一项多中心,头对头的第3期研究,涉及80位阵发性夜间血红蛋白尿(PNH)成年人。这项研究的主要目的是确定与Soliris®(依库丽单抗)相比,Empaveli™(pegcetacoplan)的功效和安全性。参加检查的参与者必须接受Soliris(至少三个月稳定),血红蛋白水平<10.5 g / dL。在为期四周的磨合期间,除了当前剂量的Soliris外,每周两次(n = 41)为患者服用1080 mg的Empaveli。在16周的随机对照期内,患者被随机分配为每周两次接受1080 mg Empaveli或当前剂量的Soliris(n = 39)。
这项研究是与SFJ Pharmaceuticals合作完成的,SFJ Pharmaceuticals支持Empaveli在PNH中的发展。SFJ是一家全球药物开发公司,为世界顶级制药和生物技术公司提供独特且高度定制的联合开发合作伙伴模型。
关于Empaveli™(pegcetacoplan)
Empaveli™(pegcetacoplan)是针对补体级联反应中枢蛋白C3的首个也是唯一获得批准的疗法。Empaveli在补体级联的近端起作用,控制C3b介导的血管外溶血和终末补体介导的血管内溶血。Empaveli在美国被批准用于治疗阵发性夜间血红蛋白尿(PNH)的成年人。
美国Empaveli重要安全信息
盒装警告:封装的细菌引起严重感染
脑膜炎球菌感染可能发生在使用Empaveli治疗的患者中,如果不及早发现和治疗,可能会迅速威胁生命或致命。使用Empaveli可能使个体容易受到严重感染,尤其是由包膜细菌引起的感染,例如肺炎链球菌,A,C,W,Y和B型脑膜炎奈瑟菌和B型流感嗜血杆菌。
遵守最新的免疫实践咨询委员会(ACIP)的建议,以针对封装的细菌进行疫苗接种。
除非先后服用Empaveli延误治疗的风险大于发生严重感染的风险,否则应在首次服用Empaveli之前至少2周给患者接种疫苗。
接种疫苗可减少但不能消除严重感染的风险。监视患者是否有严重感染的早期迹象,如果怀疑有感染,应立即进行评估。
Empaveli仅可通过“风险评估和缓解策略(REMS)”下的受限计划获得。根据EMPAVELI REMS,开药者必须注册该程序。
禁忌症
对pegcetacoplan或任何赋形剂过敏
当前尚未针对某些封装的细菌进行疫苗接种,除非延迟Empaveli治疗的风险大于封装的生物发生细菌感染的风险
由封装的细菌(包括肺炎链球菌,脑膜炎奈瑟氏球菌和流感嗜血杆菌)引起的未解决的严重感染
警告和注意事项
封装细菌引起的严重感染
Empaveli的使用可能使个人容易遭受由封装细菌(包括肺炎链球菌,脑膜炎奈瑟氏球菌A,C,W,Y和B型和流感嗜血杆菌型)引起的严重,威胁生命或致命的感染。B(Hib)。为了降低感染的风险,所有患者均必须根据最新的ACIP建议针对与补体缺乏症相关的免疫能力改变的患者接种这些细菌的疫苗。根据Empaveli的治疗时间,根据ACIP建议为患者重新接种。
对于没有已知疫苗接种史的患者,应在接受第一剂Empaveli之前至少2周施用所需疫苗。如果需要立即用恩帕韦利(Empaveli)治疗,应尽快施用所需的疫苗,并为患者提供2周的抗菌药物预防。
密切监视患者是否有严重感染的早期征兆和症状,如果怀疑感染,应立即评估患者。及时治疗已知感染。如果不及早发现和治疗,严重的感染可能会迅速威胁生命或致命。考虑接受严重感染治疗的患者应停止使用EMPAVELI。
EMPAVELI REMS
由于存在严重感染的风险,Empaveli仅可通过REMS下的受限程序获得。根据Empaveli REMS,开药者必须参加该计划,并且必须就严重感染的风险向患者提供咨询,为患者提供REMS教育资料,并确保为患者接种包封细菌。可以通过以下电话获取注册和其他信息:1-888-343-7073或访问www.empavelirems.com。
输注相关反应
Empaveli治疗的患者发生全身性超敏反应(例如面部肿胀,皮疹,荨麻疹)。一名患者(在临床研究中不到1%)经历了严重的过敏反应,在用抗组胺药治疗后得以缓解。如果发生严重的超敏反应(包括过敏反应),请立即停止Empaveli输注,按照护理标准进行适当治疗,并监测直至症状和体征消失。
监测Empaveli
停用后的PNH表现停止使用Empaveli治疗后,密切监测溶血的体征和症状,通过LDH水平升高以及PNH克隆大小或血红蛋白突然减少,或症状如疲劳,血红蛋白尿,腹部疼痛的再次出现来确定溶血的体征和症状,呼吸困难,主要不良血管事件(包括血栓形成),吞咽困难或勃起功能障碍。监测任何中断Empaveli至少8周的患者,以发现溶血和其他反应。如果在Empaveli停用后发生溶血,包括LDH升高,请考虑重新开始使用Empaveli治疗。
干扰实验室测试
凝血板中的二氧化硅试剂和Empaveli之间可能存在干扰,从而导致人工延长了活化的部分凝血活酶时间(aPTT);因此,应避免在凝结板中使用二氧化硅试剂。
不良反应
Empaveli与依库丽单抗最常见的不良反应(发生率≥10%)是注射部位反应(39%vs. 5%),感染(29%vs. 26%),腹泻(22%v。)。 3%),腹痛(20%对10%),呼吸道感染(15%对13%),病毒感染(12%对8%)和疲劳(12%对23%)。
在特定人群中的使用
对孕妇有生殖潜能的雌性可能对胚胎胎儿造成伤害。建议在使用Empaveli治疗之前,对具有生殖能力的女性进行妊娠试验。建议有生殖潜力的女性患者在用Empaveli治疗期间以及最后一次用药后的40天内使用有效的避孕方法。
请参阅完整的处方信息,包括有关由封装细菌引起的严重感染的盒装警告和《用药指南》。
关于Apellis与Sobi的合作
Apellis与Sobi于2020年10月开始合作开发系统化的pegcetacoplan并将其商业化。两家公司都拥有系统性pegcetacoplan的全球联合开发权。Apellis在美国拥有系统性Pegcetacoplan的独家商业化权利,并保留眼科Pegcetacoplan的全球商业权,包括地理萎缩(GA)。Sobi拥有系统性Pegcetacoplan在美国以外的独家商业化权利。
关于Apellis
Apellis Pharmaceuticals,Inc.是一家全球性生物制药公司,致力于利用勇敢的科学,创造力和同情心提供改变生命的疗法。靶向C3治疗的领导者,我们的目标是开发针对广泛衰弱性疾病的转化疗法,这些疾病由补体级联的过度激活驱动,包括血液学,眼科,
肾病学和神经病学。有关更多信息,请访问http://apellis.com。
Apellis前瞻性声明
本新闻稿中有关未来期望,计划和前景的声明,以及与非历史事实有关的任何其他声明,可能构成《 1995年私人证券诉讼改革法案》所定义的“前瞻性声明”。包括但不限于有关交易所预期关闭的声明。“预期”,“相信”,“继续”,“可能”,“估计”,“期望”,“打算”,“可能”,“计划”,“潜力”,“预测”,“项目”等词“应该”,“目标”,“将”,“将”和类似的表述旨在标识前瞻性陈述,尽管并非所有前瞻性陈述都包含这些标识性词。由于各种重要因素,实际结果可能与此类前瞻性陈述所表明的结果存在重大差异,包括是否满足交易所关闭的条件,以及2021年4月28日与美国证券交易委员会在Apellis 10-Q表季度报告中的“风险因素”部分中讨论的其他因素,以及Apellis可能会向证券交易委员会提交的其他文件。本新闻稿中包含的任何前瞻性陈述仅代表截至本新闻稿发布之日,并且Apellis明确否认有任何义务因新信息,未来事件或其他原因而更新任何前瞻性陈述。2021年以及Apellis可能向美国证券交易委员会提交的其他文件中所述的风险。本新闻稿中包含的任何前瞻性陈述仅代表截至本新闻稿发布之日,并且Apellis明确否认有任何义务因新信息,未来事件或其他原因而更新任何前瞻性陈述。2021年以及Apellis可能向美国证券交易委员会提交的其他文件中所述的风险。本新闻稿中包含的任何前瞻性陈述仅代表截至本新闻稿发布之日,并且Apellis明确否认有任何义务因新信息,未来事件或其他原因而更新任何前瞻性陈述。
1. McKinley C.用依库丽单抗治疗的PNH患者由于C3负荷引起的血管外溶血:定义临床综合征。血液。2017; 130:3471。
2.鼎力ASH 2020摘要/ p.1 /方法/ ln.1-2; p.2 /结果/ln.7-9;ln.14-15。
资料来源:Apellis Pharmaceuticals,Inc.。
发表于:2021年5月