FDA批准Evkeeza(evinacumab-dgnb)用于纯合子家族性高胆固醇血症患者
- 热度: ℃
- 来源:网络收集
- 收录时间:2021-02-19
导读:Evkeeza(evinacumab-dgnb)是一种血管生成素样3(ANGPTL3)抑制剂,可作为其他低密度脂蛋白胆固醇(LDL-C)降低疗法的辅助药物,用于治疗12岁以上的成年和儿科患者,纯合子家族性高胆固醇
公司: Regeneron Pharmaceuticals,Inc
.批准日期: 2021年2月11日
治疗:纯合子家族性高胆固醇血症
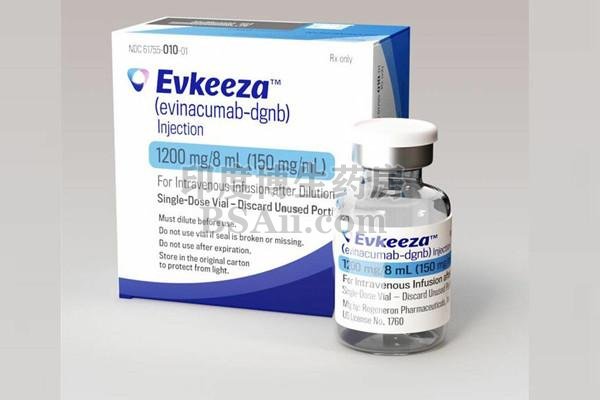
Evkeeza(evinacumab-dgnb)是一种血管生成素样3(ANGPTL3)抑制剂,可作为其他低密度脂蛋白胆固醇(LDL-C)降低疗法的辅助药物,用于治疗12岁以上的成年和儿科患者,纯合子家族性高胆固醇血症(HoFH)。
纽约州塔里敦,2021年2月11日,美通社-PR Newswire /-Regeneron Pharmaceuticals,Inc.(NASDAQ:REGN)今天宣布,美国食品药品监督管理局(FDA)批准将Evkeeza(evinacumab-dgnb)用作其他低血糖药物的辅助药物降低密度脂蛋白胆固醇(LDL-C)的疗法,可治疗12岁及以上的纯合子家族性高胆固醇血症(HoFH)的成年和儿科患者。Evkeeza是首个获得FDA批准的治疗药物,它结合并阻断血管生成素样3(ANGPTL3)的功能,而血管生成素样3(ANGPTL3)在脂质代谢中起关键作用。
FH基金会创始人兼首席执行官Katherine A. Wilemon表示:“ FDA对Evkeeza的批准,是出生于HoFH(严重的家族性高胆固醇血症)的个人的分水岭。“那些患有HoFH的人面临着毁灭性的高LDL-C水平和不确定的未来。Evkeeza在临床试验中大大降低了LDL-C的水平,这种新疗法为患有HoFH的人们提供了重要的新选择。”
HoFH,也称为纯合子FH,是一种超罕见的遗传病,在美国大约有1,300例患者受到感染。HoFH发生于遗传了两个拷贝的家族性高胆固醇血症(FH)致病基因,每个亲本都有一个,导致危险的高-LDL-C(坏胆固醇)水平(> 400 mg / dL)。患有HoFH的患者早在十几岁时就有患过早的动脉粥样硬化疾病和心脏事件的风险。
宾夕法尼亚大学佩雷尔曼医学院遗传学系教授兼系主任丹尼尔·J·拉德(Daniel J. Rader)博士说:“ Evkeeza对HoFH患者而言可能是一种潜在的变革性新疗法。” Evkeeza临床试验。“现有的针对HoFH的疗法对大多数患者来说是不够的。Evkeeza通过其独特的作用机制显示,它可以降低所有形式的HoFH患者的LDL-C水平,甚至包括那些几乎没有LDL受体活性的患者。我们控制HoFH患者LDL-C水平的能力有了非常有意义的改善。”
“ Evkeeza是首个获得FDA批准的ANGPTL3抑制剂,也是Regeneron开发方法承诺的最新例证,该方法利用遗传学见解和开创性技术为有需要的患者提供新的治疗选择,”医学博士George D. Yancopoulos博士说。 Regeneron总裁兼首席科学官D. “我们很荣幸将Evkeeza带给HoFH患者,Regeneron感谢参与我们试验的患者和医生将其变为现实。”
FDA的批准基于2020年8月发表在《新英格兰医学杂志》(NEJM)上的ELIPSE HoFH 3期试验的结果。在该试验中,随机分65例患者每四周静脉注射15毫克/公斤的依维酮(n = 43)加上其他降脂疗法,与单独的降脂疗法相比(安慰剂,n = 22)。两组患者的平均LDL-C基线水平均为255 mg / dL。
该试验达到了其主要终点,在第24周时,与安慰剂相比,接受Evkeeza治疗的患者的LDL-C与基线水平相比平均降低了49%(Evkeeza降低47%,安慰剂增加2%,p <0.0001)。与基线相比,在同一时间点,接受Evkeeza治疗的患者还经历了:
与安慰剂相比,LDL-C平均减少132 mg / dL(Evkeeza减少135 mg / dL,安慰剂减少3 mg / dL,p <0.0001)。
与安慰剂相比,在其他关键的次要终点,包括载脂蛋白B(ApoB),非高密度脂蛋白胆固醇(non-HDL-C)和总胆固醇的水平也显着降低(所有指标p <0.0001)。
在最难治疗的患者中,由于LDL受体功能有限,通常对某些其他疗法无反应,LDL-C水平也降低了类似水平,称为“无效/无效”(<15%LDL受体功能(通过体外测定)或“阴性/阴性”(通过变异分析可能导致最低限度甚至没有LDL受体功能的遗传变异)患者。
最早在第2周就观察到了Evkeeza引起的LDL-C降低,并且在整个双盲治疗期(第24周)和开放标签试验期(直到第48周)一直保持这种降低。
安慰剂对照试验联合安全性分析报告的最常见的不良反应(> 3%),是鼻咽炎(16%),在Evkeeza患者(n = 81)比安慰剂(n = 54)发生的频率更高(24%) Evkeeza,13%安慰剂),流感样疾病(7%Evkeeza,6%安慰剂),头晕(6%Evkeeza,0%安慰剂),鼻漏(5%Evkeeza,0%安慰剂),恶心(5%Evkeeza,2 %安慰剂),四肢疼痛(4%Evkeeza,0%安慰剂)和乏力(4%Evkeeza,0%安慰剂)。在临床试验中,不良反应导致2%的接受Evkeeza治疗的患者中止治疗,包括1例经治疗解决的过敏反应和2%接受安慰剂的患者。
Evkeeza每月通过静脉输注一次,以体重(15 mg / kg)为基础。在美国,每名患者的平均批发采购成本(WAC)将根据体重而有所不同,预计平均每年约为450,000美元。Regeneron致力于帮助开出Evkeeza处方的患者使用药物。Regeneron的myRARE™患者支持计划为需要帮助的合格患者提供经济援助,而他们需要支付Evkeeza的实际费用。根据该计划,符合条件的商业保险患者可能只需为Evkeeza支付$ 0的自付费用。此外,myRARE™还提供资源来帮助患者和医疗保健提供者开始使用Evkeeza,包括产品信息,保险利益验证,社区资源和预约提醒。
FDA在2017年决定授予Evkeeza突破性治疗指定用于HoFH患者的高胆固醇血症后,根据优先审评评估了Evkeeza。FDA保留对严重疾病的安全性或功效有重大改善的药物的优先审查,其突破性疗法名称旨在加快针对严重或威胁生命状况的药物的开发和美国审查。
Evkeeza的安全性和有效性尚未在其他原因引起的高胆固醇血症患者中确立,包括那些杂合性家族性高胆固醇血症(HeFH)患者。Evkeeza对心血管发病率和死亡率的影响尚未确定。
关于Evkeeza(evinacumab-dgnb)
Evkeeza是一种完全人单克隆抗体,可结合并阻断ANGPTL3的功能。二十多年前,再生元科学家发现了血管生成素基因家族。Regeneron遗传学中心的科学家于2017年在NEJM上发表的人类遗传学研究发现,ANGPTL3基因功能不正常(称为“功能缺失突变”)的患者的关键血脂水平明显降低,包括LDL-C,这与降低冠状动脉疾病的风险有关。
Evkeeza是使用Regeneron的VelocImmune®技术发明的,该技术利用专有的基因工程小鼠平台,并赋予了基因人源化的免疫系统,以产生优化的完全人源化抗体。VelocImmune技术也已用于创建多种抗体,包括Dupixent®(dupilumab),Libtayo®(cemiplimab-rwlc),Pluluent®(alirocumab),Kevzara®(sarilumab),Inmazeb™(atoltivimab,maftivimab和odesivimab-ebgn)和Regeneron针对COVID-19的抗体混合物,最近在美国获得了紧急使用授权(EUA)
欧盟正在对Evkeeza进行监管审查。2020年6月,欧洲药品管理局人类用药用产品委员会(CHMP)建议根据该产品的高度未满足的医疗需求和治疗创新,对Evkeeza进行加速评估。
重要披露:
FH基金会是501(c)-3的公共慈善机构,从联邦拨款,包括Regeneron在内的制药公司,实验室和医疗设备公司以及受家族性高胆固醇血症和脂蛋白(a)影响的个人和家庭的捐赠中获得资金支持。
Rader博士已从Regeneron获得了研究支持和咨询费用,包括在evinacumab顾问委员会上的服务,并且Regeneron为在Penn Medicine Biobank中开展的工作提供了实物支持。
EVKEEZA(evinacumab-dgnb)注射的重要安全信息
谁不应该使用Evkeeza?
如果您对evinacumab-dgnb或Evkeeza中的任何成分过敏,请不要使用Evkeeza。
在收到Evkeeza之前,请告知您的医疗保健提供者所有您的医疗状况,包括您是否:
正在怀孕或计划怀孕。Evkeeza可能会伤害您未出生的婴儿。告诉您的医疗服务提供者您在使用Evkeeza时是否怀孕。能够怀孕的人:
您的医疗保健提供者可能会在开始使用Evkeeza治疗之前进行妊娠试验
在治疗期间以及末次服用Evkeeza后至少5个月内,您应使用有效的节育方法。与您的医疗保健提供者讨论您可以在此期间使用的节育方法。
正在母乳喂养或计划母乳喂养。不知道Evkeeza是否会进入母乳。您和您的医疗保健提供者应决定是否接受Evkeeza或母乳喂养。
告诉您的医疗保健提供者您服用的所有药物,包括处方药和非处方药,维生素和草药补品。
Evkeeza可能有哪些副作用?
Evkeeza可能导致严重的副作用,包括:
过敏反应(超敏),包括称为过敏反应的严重反应。如果您有以下任何症状,请立即告知您的医疗服务提供者:肿胀(主要是嘴唇,舌头或喉咙,难以吞咽或呼吸),呼吸困难或喘鸣,感到头晕或晕厥,皮疹,荨麻疹和瘙痒。
Evkeeza最常见的副作用包括普通感冒,类似流感的症状,头晕,腿或手臂疼痛,恶心和精力下降。
告诉您的医疗保健提供者您是否有困扰您或不消失的副作用。这些并非Evkeeza的所有可能的副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
关于再生元
Regeneron(纳斯达克股票代码:REGN)是一家领先的生物技术公司,致力于为重症患者发明能改变生命的药物。由医师科学家创立并领导了30多年,我们反复不断地将科学转化为医学的独特能力导致了9种FDA批准的治疗方法和众多候选产品的开发,几乎所有这些方法都在我们的实验室内自行研发。我们的药品和管道旨在帮助患有眼部疾病,过敏性和炎症性疾病,癌症,心血管和代谢性疾病,疼痛,传染病和罕见疾病的患者。
Regeneron正在通过我们专有的VelociSuite®技术(例如VelocImmune)来加速和改善传统药物开发过程,该技术使用独特的基因人源化小鼠来产生优化的全人抗体和双特异性抗体,并通过雄心勃勃的研究计划(例如Regeneron遗传学中心) ,这是世界上最大的遗传测序工作之一。
前瞻性陈述和数字媒体的使用
本新闻稿包含前瞻性陈述,涉及与Regeneron Pharmaceuticals,Inc.(以下简称“ Regeneron”或“ Company”)的未来事件和未来表现有关的风险和不确定性,实际事件或结果可能与这些前瞻性陈述存在重大差异-看起来的陈述。诸如“预期”,“期望”,“打算”,“计划”,“相信”,“寻求”,“估计”之类的词语以及类似的表述旨在识别此类前瞻性陈述,尽管并非所有的前瞻性陈述都包含这些识别词。这些声明令人担忧,这些风险和不确定因素包括SARS-CoV-2(引起COVID-19大流行的病毒)对再生元的影响。Regeneron的业务及其员工,合作者和供应商以及其他第三方,Regeneron及其合作者继续进行研究和临床计划的能力,Regeneron管理其供应链的能力,所销售产品的净产品销售或其他方式由Regeneron和/或其合作者(统称为“ Regeneron产品”)和全球经济进行商业化;Regeneron和/或其合作者(统称为“ Regeneron产品候选产品”)正在开发或计划中的Regeneron产品和候选产品的性质,时机,可能的成功以及治疗应用,以及正在进行或计划中的研究和临床计划,包括但不限于EvkeezaTM(evinacumab-dgnb)作为其他低密度脂蛋白胆固醇(LDL C)降低疗法的辅助方法,以治疗12岁及以上的纯合子家族性高胆固醇血症(HoFH)的成年和儿科患者; Regeneron产品(例如Evkeeza)和Regeneron产品候选产品的市场接受度和商业成功的不确定性,以及研究(无论是由Regeneron还是其他机构进行,无论是强制性还是自愿的)对Regeneron产品和Regeneron产品候选产品的商业成功的影响;Regeneron产品候选产品可能获得监管批准和商业发布的可能性,时机和范围(包括欧盟Evkeeza可能的监管批准)以及Regeneron产品的新适应症;因患者服用Regeneron产品(例如Evkeeza)和Regeneron产品候选产品而引起的安全性问题,包括在临床试验中使用Regeneron产品和Regeneron产品候选产品相关的严重并发症或副作用;监管和行政政府部门的决定可能会延迟或限制Regeneron继续开发或商业化Regeneron产品和Regeneron产品候选产品的能力;对Regeneron产品,研究和临床计划以及业务(包括与患者隐私有关的义务)的持续监管义务和监督;Regeneron产品(例如Evkeeza)可从第三方付款方获得退款的程度和费用,包括私人付款人的医疗保健和保险计划,健康维护组织,药房福利管理公司以及诸如Medicare和Medicaid的政府计划;这些付款人的承保范围和报销决定,以及这些付款人采用的新政策和程序;可能比Regeneron产品和Regeneron产品候选产品更好或更具成本效益的竞争性药物和产品候选产品;Regeneron和/或其合作者进行的研究和开发计划的结果可以在其他研究中复制的程度,和/或导致候选产品进入临床试验,治疗应用或监管部门批准的程度;再生元制造和管理多种产品和候选产品的供应链的能力;Regeneron的合作者,供应商或其他第三方(如适用)执行与Regeneron产品和Regeneron产品候选产品相关的制造,填充,精加工,包装,标签,分配和其他步骤的能力;意外费用;开发,生产和销售产品的成本;再生元实现其任何财务预测或指导的能力以及对这些预测或指导的假设进行更改的能力;任何许可,合作或供应协议(包括Regeneron与赛诺菲,拜耳和Teva Pharmaceutical Industries Ltd.(或它们各自的关联公司,如适用)的协议)被取消或终止的可能性;以及与其他方的知识产权以及与此相关的未决或将来的诉讼相关的风险(包括但不限于与EYLEA®(aflibercept)注射剂,Dupixent®(dupilumab),Pluluent®(alirocumab)和REGEN相关的专利诉讼和其他相关程序) -COVTM(casirivimab和imdevimab)),与公司和/或其运营有关的其他诉讼和其他诉讼以及政府调查,任何此类诉讼和调查的最终结果以及上述任何内容可能对Regeneron的业务造成影响,前景,经营成果和财务状况。Regeneron在美国证券交易委员会的备案文件(包括截至2020年12月31日的10-K表)中可以找到对这些及其他重大风险的更完整描述。任何前瞻性陈述都是根据管理层当前的信念和判断做出的,并告诫读者不要依赖Regeneron所作的任何前瞻性陈述。对于任何新信息,未来事件或其他情况,Regeneron均不承担任何义务(公开或以其他方式)更新任何前瞻性陈述,包括但不限于任何财务预测或指导。
Regeneron使用其媒体和投资者关系网站以及社交媒体渠道发布有关公司的重要信息,包括可能被视为对投资者重要的信息。
消息来源Regeneron Pharmaceuticals,Inc.
发表于:2021年2月