转移性宫颈癌新药Tivdak (tisotumab vedotin-tftv) 注射用冻干粉
- 热度: ℃
- 来源:网络收集
- 收录时间:2021-09-29
导读:Tivdak(tisotumab vedotin-tftv)是一种组织因子导向的抗体和微管抑制剂偶联物,用于治疗复发性或转移性宫颈癌患者。
公司: Seagen Inc.
批准日期: 2021 年 9 月 20 日
治疗:宫颈癌
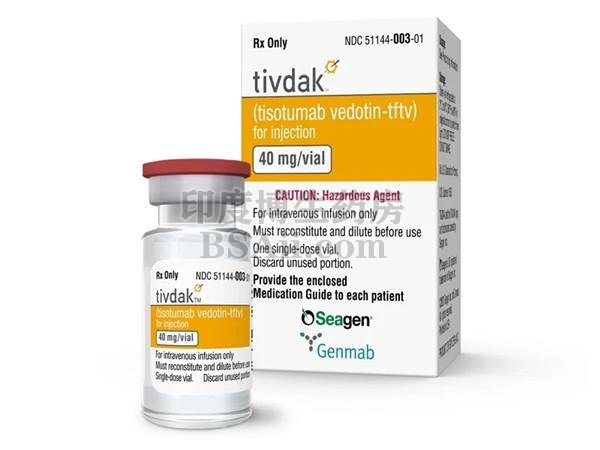
Tivdak(tisotumab vedotin-tftv)是一种组织因子导向的抗体和微管抑制剂偶联物,用于治疗复发性或转移性宫颈癌患者。
(FDA) Tivdak ™ (tisotumab vedotin-tftv) 已获得加速批准,这是第一个也是唯一一个获批的抗体药物偶联物 (ADC),用于治疗化疗期间或之后疾病进展的复发性或转移性宫颈癌成人患者。Tivdak 基于
肿瘤反应和反应的持久性,在 FDA 的加速批准计划下获得批准。继续批准可能取决于验证性试验中对临床益处的验证和描述。
“一旦复发性或转移性宫颈癌进展,就需要为这些患者提供更多选择,”美国
肿瘤学研究首席科学官兼 innovaTV 204 临床试验首席研究员 Robert L. Coleman 医学博士说。“对于复发性或转移性宫颈癌患者来说,这是一个重要的进展。”
在 innovaTV 204 临床试验中,Tivdak 在 101 名复发性或转移性宫颈癌患者中进行了评估,这些患者在复发性或转移性环境中接受过不超过两种既往全身性治疗方案,包括至少一种既往含铂化疗方案。独立审查委员会 (IRC) 使用实体瘤反应评估标准 (RECIST) v1.1 标准评估了试验结果,确认客观反应率 (ORR) 为 24%(95% CI;15.9-33.3)。中位反应持续时间 (DOR) 为 8.3 个月(95% CI;4.2 至未达到)。
Tivdak 的处方信息包括眼部毒性的黑框警告,以及周围神经病变、出血、肺炎和胚胎-胎儿毒性的警告。最常见 (≥25%) 的不良反应,包括实验室异常,是血红蛋白降低 (52%)、疲劳 (50%)、淋巴细胞减少 (42%)、恶心 (41%)、周围神经病变 (39%)、脱发(39%)、鼻衄(39%)、结膜不良反应(37%)、出血(32%)、白细胞减少(30%)、肌酐增加(29%)、干眼症(29%)、凝血酶原国际标准化比率增加 (26%)、活化部分凝血活酶时间延长 (26%)、腹泻 (25%) 和皮疹 (25%)。请参阅下面的重要安全信息。
“我们很高兴看到这种新疗法获得 FDA 批准。我们很高兴能为这种毁灭性的疾病提供另一种选择,”Cervivor 创始人 Tamika Felder 表示。
“我们对 Tivdak 的加速批准感到高兴,Tivdak 是 Seagen 的第三个 FDA 批准的抗体药物偶联物,也是第四个批准的药物。我们在 Seagen 的使命是开发对受癌症影响的人产生影响的药物,” Seagen 首席医疗官 Roger Dansey 医学博士表示。
“ Tivdak 在美国被批准作为单一疗法对于在化疗期间或之后疾病进展的复发性或转移性宫颈癌女性来说是一个重要的里程碑,因为她们需要一种新的治疗选择,我们期待为她们提供这种选择, ” Genmab 首席执行官 Jan van de Winkel 博士表示。“ Tivdak 获得批准的旅程始于近二十年前 Genmab 和 Seagen 科学家的创新研究,反映了我们对癌症患者及其家人的生活产生影响的目的。今天的公告标志着 Genmab 已发展成为一家完全整合的生物技术公司,我们要感谢患者、护理人员、研究人员和我们的合作者参与我们的临床研究。”
Tivdak 的生物制品许可申请 (BLA) 于 2021 年 2 月提交,并于 2021 年 4 月获得优先审查。该提交基于 innovaTV 204 试验的结果。
如果药物满足严重疾病未满足的医疗需求,则 FDA 的加速批准计划允许基于替代终点批准药物,该替代终点可以合理地预测临床获益。一项全球随机 3 期临床试验 (innovaTV 301) 正在进行中,也旨在支持全球注册。
关于宫颈癌
据估计,到 2021 年,美国将诊断出超过 14,480 例新的浸润性宫颈癌病例,4,290 名女性将死于该病。 2 宫颈癌仍然是全球女性癌症死亡的主要原因之一,超过2018.3 有 311,000 名妇女死于该病
关于 innovaTV 204 试用版
innovaTV 204 试验 (NCT03438396/GOG-3023/ENGOT-cx6) 是一项开放标签、多中心、单臂 2 期试验,在 101 名复发或转移性宫颈癌患者中评估了 tisotumab vedotin复发或转移情况下的全身方案,包括至少一种先前的铂类化疗方案。如果患者有活动性眼表疾病、任何瘢痕性结膜炎或 Stevens-Johnson 综合征的既往发作、≥2 级周围神经病变或已知凝血缺陷导致出血风险增加,则将其排除在外。根据 IRC 和 DOR 评估的 RECIST v1.1 确认了主要疗效结果指标的 ORR。
关于 Tivdak(tisotumab vedotin-tftv)
Tivdak (tisotumab vedotin-tftv) 是一种 ADC,由 Genmab 的针对组织因子 (TF) 的人单克隆抗体和 Seagen 的 ADC 技术组成,该技术利用蛋白酶可切割的接头将微管破坏剂单甲基 auristatin E (MMAE) 共价连接到抗体。非临床数据表明,Tivdak 的抗癌活性是由于 ADC 与表达 TF 的癌细胞结合,随后 ADC-TF 复合物内化,并通过蛋白水解裂解释放 MMAE。MMAE 破坏了活跃分裂细胞的微管网络,导致细胞周期停滞和细胞凋亡。在体外,Tivdak 还介导抗体依赖性细胞吞噬作用和抗体依赖性细胞毒性。
Tivdak (tisotumab vedotin-tftv) 注射用,用于静脉注射,40 mg 重要安全信息
黑框警告:眼毒性
Tivdak 引起角膜上皮和结膜的变化,导致视力改变,包括严重的视力丧失和角膜溃疡。在基线、每次给药前和根据临床指示进行眼科检查。在输注前、输注期间和输注后坚持术前用药和必要的眼部护理。扣留 Tivdak 直至改善并恢复,根据严重程度减少剂量或永久停药。
警告和注意事项
使用 Tivdak 治疗的宫颈癌患者中有 60% 发生了眼部不良反应。最常见的是结膜不良反应 (40%)、干眼症 (29%)、角膜不良反应 (21%) 和睑缘炎 (8%)。3.8% 的患者发生了 3 级眼部不良反应,其中 3.2% 的患者发生了严重的溃疡性角膜炎。一名患者出现溃疡性角膜炎伴穿孔需要角膜移植。在用推荐剂量的 Tivdak 治疗的其他肿瘤类型的患者中报告了 symblepharon 的病例。
在 innovaTV 204 中,4% 的患者视力变为 20/50 或更差,其中 1% 的患者视力变为 20/200。在视力下降至 20/50 或更差的患者中,75% 得到解决,包括视力下降至 20/200 的患者。
将患者转诊给眼科护理提供者进行眼科检查,包括基线时、每次给药前和临床指示时的视力和裂隙灯检查。坚持术前用药和必要的眼部护理,以降低眼部不良反应的风险。如果患者出现任何新的或恶化的眼部体征和症状,应立即将患者转诊给眼科护理提供者。根据不良反应的严重程度,扣留剂量、减少剂量或永久停用 Tivdak。
在整个临床试验中,使用 Tivdak 治疗的宫颈癌患者中有 42% 发生了周围神经病变 (PN);8% 的患者经历了 3 级 PN。PN 不良反应包括周围神经病变 (20%)、周围感觉神经病变 (11%)、周围感觉运动神经病变 (5%)、运动神经病变 (3%)、肌肉无力 (3%) 和脱髓鞘性周围多发性神经病变 (1%)。一名患有另一种肿瘤类型的患者以推荐剂量接受 Tivdak 治疗后出现了格林-巴利综合征。
监测患者的神经病变体征和症状。对于新的或恶化的 PN,根据 PN 的严重程度,暂停、减少剂量或永久停用 Tivdak。
在整个临床试验中,使用 Tivdak 治疗的宫颈癌患者中有 62% 发生了出血。最常见的所有级别出血不良反应是鼻衄 (44%)、血尿 (10%) 和阴道出血 (10%)。5% 的患者发生了 3 级出血。
监测患者的出血体征和症状。对于出现肺部或 CNS 出血的患者,永久停用 Tivdak。对于任何其他部位的≥2级出血,在出血消退、血红蛋白稳定、不存在可能增加继续治疗风险的出血素质、没有增加出血风险的解剖或病理状况之前,暂停使用复发。解决后,要么恢复治疗,要么永久停止 Tivdak。
肺炎:接受含有 vedotin 的抗体药物偶联物(包括 Tivdak)治疗的患者可能会发生严重的、危及生命的或致命的肺炎。在整个临床试验中接受 Tivdak 治疗的宫颈癌患者中,2 名患者 (1.3%) 出现肺炎,其中 1 名患者出现致命结果。
监测患者是否有指示肺炎的肺部症状。应通过适当的调查排除感染性、肿瘤性和其他引起症状的原因。
对于发生持续性或复发性 2 级肺炎并考虑减少剂量的患者,应停用 Tivdak。在所有 3 级或 4 级肺炎患者中永久停用 Tivdak。
胚胎-胎儿毒性: 给孕妇服用 Tivdak 可能会对胎儿造成伤害。告知患者对胎儿的潜在风险。建议有生育潜力的女性在 Tivdak 治疗期间和最后一次给药后 2 个月内使用有效的避孕措施。建议有生殖潜能女性伴侣的男性患者在 Tivdak 治疗期间和最后一次给药后 4 个月内使用有效的避孕措施。
不良反应
43%的患者发生严重不良反应;最常见的 (≥3%) 是肠梗阻 (6%)、出血 (5%)、肺炎 (4%)、PN、败血症、便秘和发热(各 3%)。接受 Tivdak 治疗的患者中有 4% 发生了致命的不良反应,包括感染性休克、肺炎、猝死和多系统器官衰竭(各 1%)。
接受 Tivdak 治疗的患者中有 13% 发生了导致永久停药的不良反应;最常见的 (≥3%) 是 PN (5%) 和角膜不良反应 (4%)。47% 的患者发生导致剂量中断的不良反应;最常见 (≥3%) 是 PN (8%)、结膜不良反应 (4%) 和出血 (4%)。23% 的患者发生导致剂量减少的不良反应;最常见(≥3%)是结膜不良反应(9%)和角膜不良反应(8%)。
最常见(≥25%)的不良反应,包括实验室异常,是血红蛋白降低(52%)、疲劳(50%)、淋巴细胞减少(42%)、恶心(41%)、PN(39%)、脱发( 39%)、鼻衄(39%)、结膜不良反应(37%)、出血(32%)、白细胞减少(30%)、肌酐增加(29%)、干眼症(29%)、凝血酶原国际标准化比率增加(26%)、活化部分凝血活酶时间延长 (26%)、腹泻 (25%) 和皮疹 (25%)。
药物相互作用
强 CYP3A4 抑制剂:与强 CYP3A4 抑制剂同时使用可能会增加未结合的单甲基 auristatin E (MMAE) 暴露,这可能会增加 Tivdak 不良反应的风险。密切监测患者的 Tivdak 不良反应。
在特定人群中使用
中度或重度肝损伤:MMAE 暴露和不良反应增加。避免使用。
哺乳期:建议哺乳期妇女在 Tivdak 治疗期间和最后一次给药后至少 3 周内不要进行母乳喂养。
关于希根
Seagen 是一家全球生物技术公司,致力于发现、开发和商业化变革性癌症药物,为人们的生活带来有意义的改变。Seagen 总部位于华盛顿州西雅图,并在加利福尼亚、加拿大、瑞士和欧盟设有办事处。有关我们已上市产品和强大管道的更多信息,请访问 www.seagen.com 并在 Twitter 上关注@SeagenGlobal。
关于 Genmab
Genmab 是一家国际生物技术公司,其核心目标是改善癌症患者的生活。20 多年来,Genmab 改变癌症治疗的愿景推动其充满激情、创新和协作的团队发明下一代抗体技术平台,并利用转化研究和数据科学,推动多种差异化癌症治疗对人们的生活产生影响。为了开发和向患者提供新疗法,Genmab 已与生物技术和制药公司建立了 20 多个战略合作伙伴关系。Genmab 的专有管道包括双特异性 T 细胞接合剂、下一代免疫检查点调节剂、效应功能增强抗体和抗体-药物偶联物。
Genmab 总部位于丹麦哥本哈根,在荷兰乌得勒支、美国新泽西州普林斯顿和日本东京设有办事处。
关于 Seagen 和 Genmab 的合作
Tisotumab vedotin 由 Genmab 和 Seagen 共同开发,根据一项协议,两家公司以 50:50 的比例分担该产品的成本和利润。