
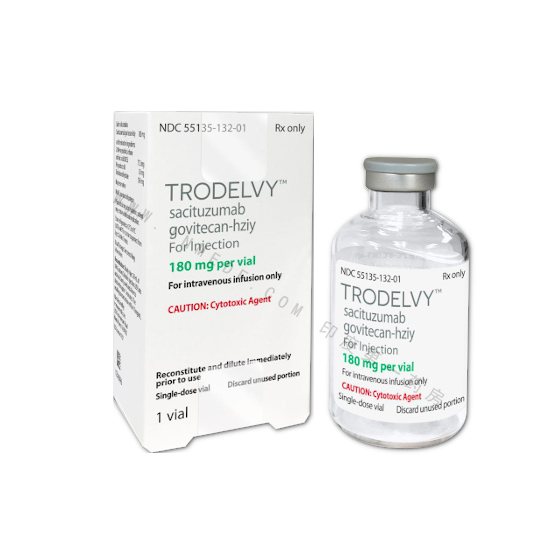
Trodelvy(sacituzumab govitecan-hziy 中文译名:赛妥珠单抗)冻干粉注射剂,用于治疗转移性三阴性乳腺癌(TNBC)的成年患者,这些患者已接受至少两种先前的转移性疾病疗法。Trodelvy是FDA批准的第一个专门针对复发性或难治性转移性TNBC的ADC,同时也是FDA批准的第一个抗Trop-2ADC。

请勿将TRODELVY替代或与其他含药物的伊立替康或其活性代谢物SN-38一起使用。
•仅用于静脉输液。不要以静脉推注或推注的方式给药。
•在连续的21天治疗周期的第1天和第8天,每周一次的建议剂量为10mg/kg,直至疾病进展或出现不可接受的毒性。
•建议进行预防输液反应和预防化学疗法引起的恶心和呕吐的预防用药。
•在输注过程中以及输注完成后至少30分钟监视患者。可能需要中断治疗和/或减少剂量以控制不良反应。
•有关准备和管理说明,请参阅完整的处方信息。
【剂量形式和强度】
注射用:将180mg冻干粉装入单剂量小瓶中,以进行重建。
(警告)本内容仅供参考,不能替代医嘱
mTNBC患者最常见的不良反应(发生率> 25%)为恶心,中性粒细胞减少,腹泻,疲劳,贫血,呕吐,脱发,便秘,皮疹,食欲下降和腹痛。
【警告和注意事项】
•超敏反应:已观察到超敏反应,包括严重的过敏反应,并监测患者输注相关的反应。如果发生严重或危及生命的反应,则永久不连续使用TRODELVY。
•恶心/呕吐:在计划治疗时对3级恶心或3-4级呕吐的患者使用止吐药预防性治疗,并扣留TRODELVY。
•UGT1A1活性降低的患者:尿苷二磷酸-葡萄糖醛酸转移酶1A1(UGT1A)1*28纯合的个体在开始TRODELVY治疗后中性粒细胞减少的风险增加。
•胚胎-胎儿毒性:TRODELVY可能导致胎儿伤害。建议患者对胎儿有潜在危险,并采取有效的避孕措施。
【药物相互作用】
•UGT1A1抑制剂或诱导剂:避免同时使用。
【在特定人群中的使用】
•哺乳期:建议不要母乳喂养。
【包装供应/存储和处理方式】
TRODELVY(sacituzumab govitecan-hziy)注射剂是单剂量的无菌,灰白色至淡黄色冻干粉末。每个TRODELVY小瓶都单独装在纸箱中:
•NDC 55135-132-01包含一个180mg小瓶
将小瓶存放在原始纸箱中2°C至8°C(36°F至46°F)的冰箱中,以防光照,直到重新配制为止。不要冻结
TRODELVY是一种细胞毒性药物。遵循适用的特殊处理和处置程序。
(警告)本内容仅供参考,不能替代医嘱
2020年4月22日,Immunomedics公司宣布,美国FDA已加速批准其抗体偶联药物Trodelvy(sacituzumab govitecan-hziy)上市,用于治疗既往接受过至少2种疗法的转移性三阴乳腺癌(mTNBC)成人患者,批准时间比预定的6月2日审批日期提前了一个半月!
这意味着,Trodelvy是FDA批准的首个治疗三阴乳腺癌的抗体偶联药物,也是全球首个获批的靶向人滋养层细胞表面抗原2(Trop-2)的抗体偶联药物。
“最毒”的亚型,三阴性乳腺癌到底有多可怕?
在中国,乳腺癌位居城市女性恶性肿瘤发病率之首,近年来发病率持续攀升。据流行病学调查显示,我国乳腺癌发病率为16万人/年,死亡率为12万人/年,发病率增速是美国的两倍。而一些熟知的女性,如“林妹妹”陈晓旭、歌星姚贝娜、阿桑等,都因乳腺癌而早逝。
作为乳腺癌中“最毒”的亚型之一,三阴性乳腺癌在所有乳腺癌中占比达到15%~20%,其恶性程度堪称所有乳腺癌中最高。这是由于三阴性乳腺癌的三个重要基因:雌激素受体、孕激素受体、人表皮生长因子受体-2(HER2)表达均为阴性,致使内分泌治疗及抗HER2靶向治疗的方案对之疗效甚微,5年内复发转移风险高达20%。
如果是晚期三阴性乳腺癌患者,治疗手段有限,容易产生耐药性,而且患者的生存期较短,是临床治疗上的一个难题。因此,为了突破这一“瓶颈”,医药研究者们将目光投向ADC药物的研发。
三阴乳腺癌的新希望:靶向药Trodelvy
其实早在2020年4月6日,Immunomedics公司宣布,提前终止其ADC药物Trodelvy(sacituzumab govitecan-hziy)治疗转移性三阴性乳腺癌(TNBC)的III期ASCENT研究。此次提前终止研究是因为实验数据堪称惊艳!
Trodelvy,大家可能会觉得很陌生,其实它还有一个代号IMMU-132。而此次研究结果发表于2019年2月的《新英格兰医学杂志》上,ASCENT研究纳入了108例既往至少接受过2种标准化疗进展复发的晚期三阴乳癌患者,以1:1的比例随机分配到Trodelvy(10mg/kg)组或其他标准化疗组(艾日布林/吉西他滨/卡培他滨/长春瑞滨)。而此次Trodelvy单药治疗的疗效堪称惊艳。
整体缓解率、临床获益率
Trodelvy单药治疗整体缓解率为33.3%,其中完全缓解率2.8%和部分缓解率30.6%,远高于传统化疗组的疗效。37%的患者疗效评价为疾病稳定,仅有25.9%的患者出现了疾病进展。最佳临床获益率高达45.4%,包含疾病稳定超过6个月的患者。
中位缓解持续时间
在对治疗有反应的39例患者中,中位反应时间为2.0个月,中位缓解持续时间为7.7个月。到数据截止时,有6例患者临床疗效持续了12个月以上,最长的达到了30.7个月。
中位无进展生存期及总生存期
Trodelvy单药治疗组中位无进展生存期(PFS)为5.5个月,估计的6个月PFS率为41.9%,到12个月时,使用Trodelvy的PFS率为15.1%。中位总生存期(OS)为13个月,估计6个月OS率为78.5%,估计12个月为51.3%。
Trodelvy有望成为又一款广谱抗癌新星
Trodelvy由两部分组成:靶向药部分Trop-2抗体和化疗药部分SN-38(类似于伊立替康)。与其他的ADC药物一样,Trop-2抗体部分可以特异地结合到肿瘤细胞表面,比如乳腺癌、肠癌和肺癌细胞;而SN-38可以轻松毒死癌细胞。
从作用机理来看,TROP-2在多种肿瘤细胞(如:乳腺癌、宫颈癌、结直肠癌、肾癌、肝癌、肺癌、胰腺癌、前列腺癌等)中均大量表达。理论上,该药对各种实体肿瘤均有治疗潜力。事实上,除三阴性乳腺癌外,多项临床试验也在同步开展中:
Trodelvy已在中国获批临床
值得一提的是,本月21日,中国国家药监局药品审评中心(CDE)最新公示,Everest公司提交的Trodelvy在中国获批一项临床试验,适应症为“接受过至少2线既往治疗的转移性三阴性乳腺癌”。这意味着随着Trodelvy获得FDA的加速批准,在不久地将来我国关于Trodelvy的临床试验将会如火如荼地展开。
(警告)本内容仅供参考,不能替代医嘱