
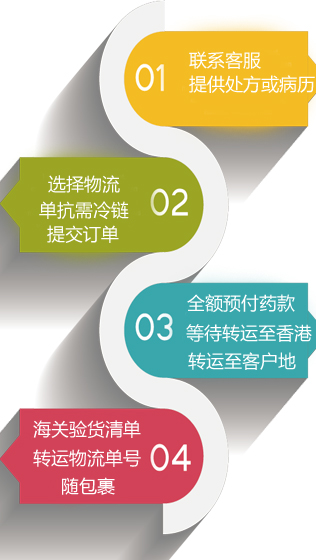
诺西那生钠注射液是全球首个脊髓性肌萎缩症 (Spinal Muscular Atrophy, SMA) 治疗药物。这种药物是用来治疗与相关的脊髓性肌萎缩症基因突变的SMN1基因。使用鞘内注射将其直接给药至中枢神经系统(CNS)。诺西那生钠在美国和欧盟拥有孤儿药的认定。

SPINRAZA鞘内地给药(2.1)
给药信息(2.1)
⑵ 推荐剂量是12 mg(5 mL)每次给药
⑵用4个负荷剂量初始SPINRAZA治疗;首次三个负荷剂量不应在14-天间隔时被给予;第4次负荷剂量应在第3次剂量后30天给予;其后应每4个月给予1次维持剂量
重要制备和给药指导(2.2)
⑴给药前令其加温至室温
⑵在4小时内从小瓶取出给药
⑶给药前抽吸5 mL脑脊液
⑶ 历时1至3分钟鞘内推注给药
实验室测试和监视评价安全性(2.3)
在基线和每次给药前,得到一个血小板计数,实验室凝血测试,和定点尿蛋白测试(警告)本内容仅供参考,不能替代医嘱
至少20%的SPINRAZA-治疗患者发生的最常见不良反应和发生至少5%更频于对照患者为下呼吸道感染,上呼吸道感染,和便秘(6.1)
(警告)本内容仅供参考,不能替代医嘱
2019年10月10日,全球首个SMA精准靶向治疗药物--诺西那生钠注射液在国内完成对首批脊髓性肌萎缩症 (Spinal Muscular Atrophy,以下简称SMA)患儿的鞘内注射,开启了SMA治疗的新里程。
脊髓性肌萎缩症(Spinal Muscular Atrophy,SMA)是一种罕见的遗传性神经肌肉疾病,在新生儿中发病率约为 1/6000-1/10000。根据起病年龄和运动里程的获得情况,SAM分为SMA-I型、II型、III型和IV型,如果不进行治疗,大多数SMA-I型的患儿无法存活到两岁。诺西那生钠注射液上市之前,此病属于无药可治的情况,国内及全世界范围内对SMA的治疗措施仅限于呼吸支持、营养支持、骨科矫形等辅助治疗方法。
诺西那生钠注射液(美国及欧盟注册商品名SPINRAZA),渤健公司(Biogen Idec Ltd)研发,2016年12月23日首次在美国获批,是全球首个SMA精准靶向治疗药物,目前,该药物已在欧盟、巴西、日本、韩国、加拿大等国家获得批准用于治疗SMA。2019 年 2 月 22 日,诺西那生钠注射液正式获得国家药品监督管理局批准,用于治疗5q 脊髓性肌萎缩症(SMA),并成为中国首个治疗脊髓性肌萎缩症 (SMA) 的药物。
诺西那生钠(Spinraza)是一种反义寡核苷酸,可改变SMN2基因的剪接,增加全功能性SMN蛋白的生产,属于一种基因疗法药物。诺西那生钠注射液通过鞘内注射给药,可以直接将药物输送到脊髓周围的脑脊液中,从而改善运动功能、提高生存率,改变SMA的疾病进程,该药物在2018年11月颁布的2018年国际盖伦奖(2018 International Prix Galien)中荣获"最佳生物技术产品"的荣誉。
诺西那生钠注射液(Spinraza)在美国的治疗费用相当昂贵,定价为12.5万美元/针,首年需要注射6次,治疗费用约75万美元,第二年的费用降低一半至37.5万美元。在国内该药目前售价为每支69.7万元,属于完全自费药物,已创下了中国药品售价的新纪录,我们期待SMA药物能早日纳入国家或地方医保药品目录,帮助SMA患者家庭解决治疗负担,让保障罕见病患者用药真正成为现实。
图 Spinraza销售数据
诺西那生钠注射液(Spinraza)在美国及欧盟均获得孤儿药资格,2018年5月,SMA被列入中国国家卫生健康委员会等部门联合制定的《第一批罕见病目录》中。Spinraza在国内的整个审批周期不到6个月(173天),距离Spinraza在美国首次获批也只有2年零2个月(794天)。这种审批速度得益于国家实施的针对罕见病及临床急需的境外新药的系列政策:
2017年12月国家食品药品监督管理总局发布《总局关于鼓励药品创新实行优先审评审批的意见》,其中明确提出将罕见病加入优先审评范围。
2018年5月国家药品监督管理局、国家卫生健康委员会发布《关于优化药品注册审评审批有关事宜的公告》,其中明确对于境外已上市的防治严重危及生命且尚无有效治疗手段疾病以及罕见病药品,进口药品注册申请人经研究认为不存在人种差异的,可以提交境外取得的临床试验数据直接申报药品上市注册申请。
2018年6月20日的国务院常务会议提出,有序加快境外已上市新药在境内上市审批,对治疗罕见病的药品和防治严重危及生命疾病的部分药品简化上市要求。
2018年7月国家药品监督管理局发布《接受药品境外临床试验数据的技术指导原则》,支持符合条件的部分进口罕见病药品豁免临床进入中国。
2018年8月8日,CDE发布了第一批48个临床急需境外新药名单。
2018年9月,诺西那生钠注射液作为已在境外上市且临床急需的罕见病治疗新药被国家药品监督管理局纳入优先审评审批程序。
2018年10月31日,国家药监局会同国家卫生健康委员会发布《临床急需境外新药审评审批工作程序》及申报资料要求,建立专门通道对临床急需境外上市新药审评审批,对罕见病治疗药品和其他境外新药分别承诺在3个月、6个月内审结。
2019年3月28日,CDE发布通知,遴选出第二批30个境外已上市的临床急需新药名单。
……
国家对进口临床急需用药及罕见病用药持续关注,据不完全统计,2018年共有102个(涉及59个产品)进口药品获批,通过优先审评获批上市的有25个产品(详见表1 2018年通过优先审评获批的进口药),多为具有明显治疗优势的创新药、儿童用药及罕见病用药。其中默沙东九价宫颈癌疫苗(HPV疫苗)在中国获批上市,被称为"有史以来获批最快的一款药品",从提出申请到获批上市只用了9天,得到舆论的一片好评。另外2018年8月,罗氏阿来替尼胶囊进口注册申请获批,用于一线治疗ALK阳性晚期非小细胞肺癌,被称为"上市时滞最短的一款新药",几乎实现了海外新药在中国与欧盟同步上市,该药于2017年11月、12月在美国和欧盟获批。
另外,根据CDE公示的优先审评公示数据,2016年至今公示的纳入优先审评品种名单共有950个品种,其中进品药品为306个,2019年公示的纳入优先审评品种名单共有49个(详见表2 CDE 2019年公示的纳入优先审评的进口药品名单)。
表1 2018年通过优先审评获批的进口药
(警告)本内容仅供参考,不能替代医嘱