-
WeChat 微信客服
(打开微信扫一扫添加客服) -
微信扫描左侧二维码或加微信号
微信客服(1):bsaind -
耐心等待客服逐一处理
10-10点 - 查看更多
Global package for total price over 8000
Global package for total price over 8000
导读:膀胱癌是指发生在膀胱黏膜上的恶性肿瘤,是泌尿系统最常见的恶性肿瘤,占我国泌尿生殖系肿瘤发病率的第一位,其中膀胱癌患者总数的90%以上都是膀胱尿路上皮癌。
尿路上皮癌是发生在覆盖泌尿道上皮的一种癌症,因所有被覆盖的上皮组织都会长时间接触尿液,就极有可能受尿液当中致癌因素的影响形成癌症。尿路上皮癌包括肾盂癌,输尿管癌和膀胱癌等,其中大多数发生在膀胱造成膀胱尿路上皮癌。此外,膀胱癌是指发生在膀胱黏膜上的恶性肿瘤,是泌尿系统最常见的恶性肿瘤,占我国泌尿生殖系肿瘤发病率的第一位,其中膀胱癌患者总数的90%以上都是膀胱尿路上皮癌。
膀胱尿路上皮癌分为非肌层浸润性膀胱癌(肿瘤局限于黏膜和黏膜下层)和肌层浸润性膀胱癌(肿瘤侵犯肌层及膀胱外结构)。非肌层浸润性尿路上皮癌占初发膀胱肿瘤的70%,多采用经尿道膀胱肿瘤电切术,术后用膀胱灌注治疗预防复发,5年总生存率为90%;肌层浸润性尿路上皮癌多采用全膀胱切除术治疗,有些患者可以采用膀胱部分切除术治疗,也可先进行新辅助化疗+手术治疗的方法,浸润性膀胱癌患者行全膀胱切除术后5年生存率为60%~70%。此外,转移性膀胱癌以化疗为主,中位总体生存期约为7个月,在化疗为主的转移性尿路上皮癌治疗方案中,相比当前的免疫疗法,预后效果仍然有所欠缺,因此,在近一年时间中,陆续获批的用于尿路上皮癌的肿瘤免疫疗法为患者带来了新的方案。
PD-L1抑制剂首次用于尿路上皮癌
2016年5月18日,FDA批准罗氏肿瘤免疫疗法Tecentriq(Atezolizumab)中文名:
Tecentriq.html' title='特善奇' target='_blank'>特善奇/泰圣奇(阿特珠单抗)
用于治疗膀胱癌的最常见类型膀胱尿路上皮癌,这是FDA首次批准用于膀胱尿路上皮癌这一癌种的PD-L1抑制剂,同时也将PD-L1抑制剂成功写进免疫疗法的族谱中,与PD-1抑制剂一同为抗癌事业提供方案。Atezolizumab适用于局部晚期或转移性尿路上皮癌患者,在含铂类化疗方案治疗中或治疗后疾病出现进展;或在含铂类化疗方案术前新辅助或术后辅助治疗的12个月内。
FDA这一批准基于罗氏的一项临床研究IMvigor210的出色表现。该研究的Ⅱ期临床试验共纳入310名局部晚期或转移性尿路上皮癌患者,旨在比较用药疗效及安全性。结果表明,在所有受试人群中mOS(中位总体存活期)平均为7.9个月,而在PD-L1高表达的患者中mOS(中位总体存活期)高达11.4个月;此外,试验表明,Atezolizumab具有良好耐受性,出现的不良反应均在控制范围以内,同时不会造成患者生活质量明显下降。FDA在尿路上皮癌这一癌种上的批准,为尿路上皮癌的抗癌疗法路径开辟了新篇章。
PD-1抑制剂首次用于尿路上皮癌
紧接着在2017年2月,已获5项癌种适应症的百时美施贵宝的肿瘤免疫治疗Opdivo(Nivolumab)再添尿路上皮癌这一适应症,FDA批准Opdivo(Nivolumab)用于既往已接受治疗的局部晚期或转移性尿路上皮癌患者,其中患者为接受含铂化疗期间/化疗后或接受含铂新辅助治疗/辅助治疗后一年内病情进展的铂难治、转移性或不可切除性尿路上皮癌。
Opdivo(Nivolumab)
中文名称:opdivo100.html' title='纳武利尤单抗' target='_blank'>纳武利尤单抗(纳武单抗)欧狄沃PD-1
购买链接:https://www.indbsa.com/zhongliu/fei/2019917.html
治疗转移性尿路上皮癌这一适应症的获批,是基于一项II期临床研究CheckMate-275的数据。该研究共纳入270例含铂化疗期间/化疗后或接受含铂新辅助治疗/辅助治疗一年内病情进展的铂难治、转移性或不可切除性尿路上皮癌患者,其中PD-L1表达≥1%的患者比例为46%。结果显示,患者接受Opdivo治疗给药后,确认的ORR(客观缓解率)为19.6%、CRR(完全缓解率)为2.6%、PRR(部分缓解率)为17%。其中,在PD-L1表达≥1%的患者中,确认的ORR(客观缓解率)为25%、CRR(完全缓解率)为4.8%;PD-L1表达<1%的患者中,确认的ORR(客观缓解率)为15.1%,确认的CRR(完全缓解率)为0.7%。此外,接受Opdivo治疗的270例患者中,Opdivo治疗相关不良事件导致的停药率为17%,最常见的严重不良事件(发生率>2%)有尿路感染、败血症、腹泻、小肠梗阻、全身健康恶化,最常见的不良反应(发生率≥20%)有疲劳(46%)、骨骼肌疼痛(30%)、恶心(22%)、食欲下降(22%)。总体来说,Opdivo在尿路上皮癌患者的给药情况并未明显影响患者生活质量,对该药的疗效及安全性都有一个可观的数据。
PD-L1抑制剂用于尿路上皮癌一线治疗
2017年4月,罗氏肿瘤免疫疗法Tecentriq (Atezolizumab)再获美国FDA批准,用于治疗无法进行常规顺铂化疗的局部晚期或转移性尿路上皮癌。这一癌肿再次获批也表明将罗氏肿瘤免疫疗法Tecentriq (Atezolizumab)用于无法进行常规顺铂化疗的局部晚期或转移性尿路上皮癌患者的一线治疗。
这一癌种一线治疗的获批取决于一项由119名患者组成的IMvigor210-Cohort1临床试验,结果表明Atezolizumab治疗的患者ORR(客观缓解率)为23.5%,CRR(完全缓解率)为6.7%,PRR(部分缓解率)为16.8%;更重要的是,结果表明罗氏肿瘤免疫疗法Tecentriq (Atezolizumab)治疗患者中的ORR(客观缓解率)与PD-L1的蛋白表达并无联系。其次,Atezolizumab给药的mOS(中位总体生存期)为15.9月,其中PD-L1表达<1%组的mOS(中位总体生存期)为19.1月,而PD-L1表达≥1%组的mOS(中位总体生存期)为12.3月,治疗相关的不良事件率为66%,3-4级不良事件率为16%,其中主要的3-4级不良事件为疲劳(3%),谷丙转氨酶升高(3%),谷草转氨酶升高(3%),同时也显示该治疗方法并未明显降低患者生活质量。这一临床试验的出色数据也因此让罗氏肿瘤免疫疗法Tecentriq (Atezolizumab)成功获批用于局部晚期或转移性尿路上皮癌一线治疗。
尿路上皮癌再添PD-L1抑制剂新药
近日,在2017年5月2日,FDA宣布批准阿斯利康的肿瘤免疫疗法Imfinzi(durvalumab)上市,用于治疗在先前的铂类化疗中或化疗后病情依旧出现进展,或在接受辅助或新辅助铂类化疗的12个月内疾病出现进展的晚期或转移性尿路上皮癌患者。这是阿斯利康在肿瘤免疫疗法迈出的第一步,相信还会有更加精彩的下一步,让癌症患者再多一份希望。
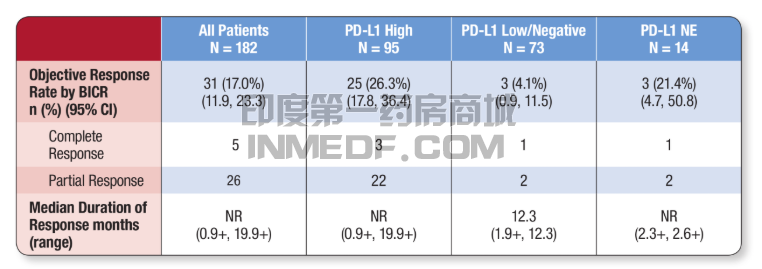
阿斯利康的肿瘤免疫疗法Imfinzi(durvalumab)的获批基于一项纳入182名先前接受铂类化疗后疾病出现进展的晚期或转移性尿路上皮癌患者的临床试验,并从中对durvalumab的疗效以及安全性得到了确认。这一临床试验结果表明,这些患者的ORR(客观缓解率)达到了17%,其中在PD-L1高度表达的95名患者中,客观缓解率达到了26.3%。这些临床试验出色表现也因此使得FDA批准该肿瘤免疫疗法Imfinzi(durvalumab)加速上市。
近一年的时间里,各路肿瘤免疫疗法巨头都在为尿路上皮癌治疗带来新的方案,PD-1/PD-L1抑制剂药物为局部晚期或转移性尿路上皮癌患者提供了从二线治疗方案到一线治疗的可观进展,切切实实的为尿路上皮癌患者带来又一个明天!